Бактеріоцини
Молочнокислі бактерії використовуються людиною з давніх-давен. Лише історія сироваріння налічує понад 7 тисячоліть. Скисання молока відбувалося внаслідок потрапляння у нього з довкілля мікрофлори, значну частку якої становили молочнокислі бактерії (МКБ). Завдяки роботам Луї Пастера прийшло розуміння природи бродіння (скисання) і важливої ролі у ньому мікроорганізмів.
Важливою особливістю молочнокислих бактерій, завдяки якій вони і отримали таку назву, є здатність утворювати з лактози молочну кислоту. Саме внаслідок накопичення молочної кислоти – головного продукту молочнокислого бродіння, відбуваються зміни структури казеїнів, що призводять до зсідання молока і утворення згустку. Було помічено, що молочна кислота, як і деякі інші органічні кислоти, виявляє бактерицидну чи бактеріостатичну дію на певні види мікроорганізмів. Згодом виявлено інші продукти метаболізму молочнокислих бактерій, які здатні пригнічувати розвиток сторонньої мікрофлори: перекис водню, діацетил, етанол, леткі жирні кислоти, вуглекислий газ, лізоцим, специфічні субстанції білкової природи – бактеріоцини.
Передумови виникнення та форми прояву антагоністичної активності МКБ
Багато грампозитивних і грамнегативних бактерій протягом свого росту виділяють специфічні речовини білкової природи (протеїни, пептиди), що мають антимікробну активність проти інших мікроорганізмів. Такі сполуки мають загальну назву – бактеріоцини, що свідчить про їх природу і походження (виділені з бактерій). Серед грампозитивних бактерій особливу увагу привертають молочнокислі бактерії, а саме їх бактеріоцини. Оскільки багато видів МКБ належать до резидентної нормальної мікрофлори різних біотопів людини, тому дані бактерії і, відповідно їх метаболіти, вважаються безпечними (GRAS) для людини і можуть слугувати природними консервантами в багатьох продуктах харчування.
За даними багатьох авторів, антагоністична активність молочнокислих бактерій зумовлена:
- конкуренцією за енергетичні та харчові джерела;
- нагромадженням у молоці та сирній масі кислих продуктів, внаслідок чого знижується рН до значень, які інгібують ріст та життєдіяльність кислото-чутливих груп мікроорганізмів;
- встановленням низького рівня окисно-відновного потенціалу, що обмежує розвиток та метаболізм аеробних мікроорганізмів;
- утворенням сполук неспецифічної (продукти первинного метаболізму: молочна кислота та інші органічні кислоти, діацетил, Н2О2 тощо) та специфічної антимікробної дії (бактеріоцини, антибіотичні сполуки).
Слід зазначити, що антагоністична активність МКБ залежить від таких факторів, як температура культивування, рівень початкового забруднення сировини сторонньою мікрофлорою, кількість внесеної закваски МКБ.
Доведення участі бактеріоцинів у реалізації антагонізму МКБ
Було досліджено 40 ізольованих із природних джерел штамів МКБ, 6 типових колекційних і 65 колекційних штамів умовно-патогенних мікроорганізмів у ролі індикаторних мікроорганізмів. Серед тест-мікроорганізмів були представники бактерій виду Escherichiacoli, Sеrratiamarcescens, Pseudomonasaeruginosa, Staphylococcusaureus, Enterobactercloaceae, Streptococcusagalactiae, Candidaalbicans, Proteusmirabilis, Enterococcusfaecalis.
Антагоністичну активність вивчали, використовуючи модифікований лунко-дифузійний метод (з діаметром лунок 7 мм). Для забезпечення кращої дифузії активних речовин в агар посіви витримували 1 годину при 4 оС. Антимікробну активність визначали, вимірюючи діаметри зон затримки росту індикаторних мікроорганізмів навколо лунки. Вважали, що мікроорганізм має антагоністичну активність, якщо діаметр зони затримки росту перевищує 11 мм.
Для пояснення природи антагоністичної дії МКБ використовували різні модифікації досліду: в тест-культуру вносили карбонат кальцію в концентрації 25 мкг/мл для інгібування дії молочної кислоти; додавали каталазу в кінцевій концентрації 1 мкг/мл для виключення антибактеріальної дії пероксиду водню.
У результаті проведених досліджень показано, що штами МКБ, виділені з природних субстратів, проявляли значну антимікробну дію по відношенню до ряду умовно-патогенних мікроорганізмів (спостерігалася виразна зона пригнічення росту).
У ході проведення досліджень були відзначені види бактерій з найбільш вираженою антагоністичною активністю та основні субстрати, в яких відмітили найбільшу частоту виявлення штамів МКБ з яскраво вираженими антагоністичними ознаками. Так, найбільш високу антагоністичну дію по відношенню до умовно-патогенних мікроорганізмів проявляли представники гомоферментативних бактерій виду Lactobacillusаcidophilus. Субстратами, з яких були ізольовані представники з найбільш характерно вираженими ознаками антагонізму, виявилися кисле молоко, квашені овочі та гриби.
Згідно з іншими джерелами, наявність в культуральній рідині білкових структур – бактеріоцинів (нізину) було доведено, використовуючи метод зеленого флюорисцентного білка (GFP), за допомогою якого вдалося отримати знімок внутрішньої структури нізину.
Характеристика та класифікація бактеріоцинів МКБ
Бактеріоцини, на відміну від пептидних антибіотиків, синтезуються на рибосомах (є рибосомальними пептидами) і гени, що кодують їх синтез, мають оперонний тип будови. Такі бактеріоциногенні оперони можуть бути як плазмідні, так і нуклеоїдні.
Більшість бактеріоцинів – це малі (менше 10 кДа), катіонні, термостійкі, амфіфільні, мембрано-проникні пептиди. Завдяки наявності у клітинній стінці грампозитивних бактерій аніонних полімерів – тейхоєвих і ліпотейхоєвих кислот, аніонні бактеріоцини здатні проникати всередину клітини, формуючи пори у клітинній стінці. Всі бактеріоцини складаються з залишків амінокислот чи модифікованих похідних амінокислот і проявляють свою інгібуючу дію при низьких значеннях рН.
Ряд властивостей бактеріоцинів (інактивація протеіназами і стійкість до нагрівання) підтверджують їх білкову або пептидну природу. Вивчення умов утворення бактеріоцинів представниками деяких молочнокислих бактерій Lactococcuslactis, Pediococcusacidilactici, Leuconostoccarnosum, Leuconostocmesenteroides показало, що умови, які сприяють нагромадженню клітинної маси, забезпечують найбільшу продукцію цих сполук.
Клас 1. Лантибіотики.
Бактеріоцини цієї групи є пептидними речовинами, що мають характерні поліциклічнітіоефіри амінокислот лантіоніну чи метиллантіоніну. Також до їх складу може входити дегідроаланін чи аміноізобутират. Залежно від структурних особливостей представники першого класу поділяються на 2 підкласи.
Підклас А включає лінійні, позитивно заряджені, амфіпатичні пептиди. Їхня молекулярна маса коливається між 2-4 кДа, і вони проникають через клітинну стінку грампозитивних бактерій шляхом формування пор.
Підклас Б лантибіотиків містить глобулярні, негативно чи нейтрально заряджені пептиди, що залучають до ензиматичних клітинних реакцій цільової бактерії. Молекулярна маса між 2-3 кДа.
Лантибіотики – це переважно малі (до 5 кДа), термостабільні пептиди, які піддаються модифікації після трансляції шляхом формування тіоефірних комплексів між лантіоніном і метилтантіоніном. Це відбувається у 2 етапи. Спочатку кодуються відповідним геном треонін і серин, які піддаються ферментативному дегідруванню з утворенням дегідроаланіну і дегідробутирину. Продукти останньої реакції конденсуються з 2 молекулами цистеїну і утворюються відповідно лантіонін і метиллантіонін, які утворють тіоефіри.
Представники першого класу характеризуються вузьким спектром антибактеріальної дії – викликають загибель організмів, близьких до організму-продуцента. У цей клас входять нізин, лактоцин В и F-27, аміловорин, педіоцин N5P, теpмофілін А, курвацин А, аміловорин L471, ентерококцин.
Клас 2. Нелантибіотики.
Цей клас включає термостабільні пептиди з молекулярною масою менше 10 кДа. Особливістю нелантибіотиків є відсутність у їхньому складі залишків лантіоніну і метиллантіоніну. Вони поділяються на 2 підкласи.
Підклас А, педіоцин подібні чи активні проти Listeria бактеріоцини, що мають N–термінальну послідовність амінокислот: тирозин-гліцин-аспарагін-гліцин-валін-цистеїн.
Підклас Б включає бактеріоцини, які для синергічної роботи потребують 2 відокремлених пептидних залишків. Бактеріоцини, які відносяться до другої групи, інгібують ріст багатьох видів грампозитивних мікроорганізмів, у тому числі Listeriamonocytogenes, Clostridiumbotulinum, Clostridiumsporogenes, Staphylococcusaureus, Pediococcusacidilactici, Bacillusspp., Enterococcusfaecalis. Перераховані бактерії викликають псування харчових продуктів, серед них є і патогенні види. До бактеріоцинів другої групи відносяться: педіоцин А, ацидоцин В, діацетин В-1, курвацин FS47, лактицин 3147, плантарицин С, ентерококцини, саліварцин, саркацин 674, мутацин. Показано, що більша частина цих бактеріоцинів не токсична і не іммуногенна.
Клас 3. Бактеріоцини.
Сюди відносяться термолабільні протеїни, що мають велику молекулярну масу (більше 30 кДа). Ця група бактеріоцинів не привертає широкої уваги, оскільки головний їх недолік – термолабільність, що унеможливлює їх широке використання в якості природних консервантів через неможливість поєднувати їхню дію з високотемпературною обробкою харчових продуктів.
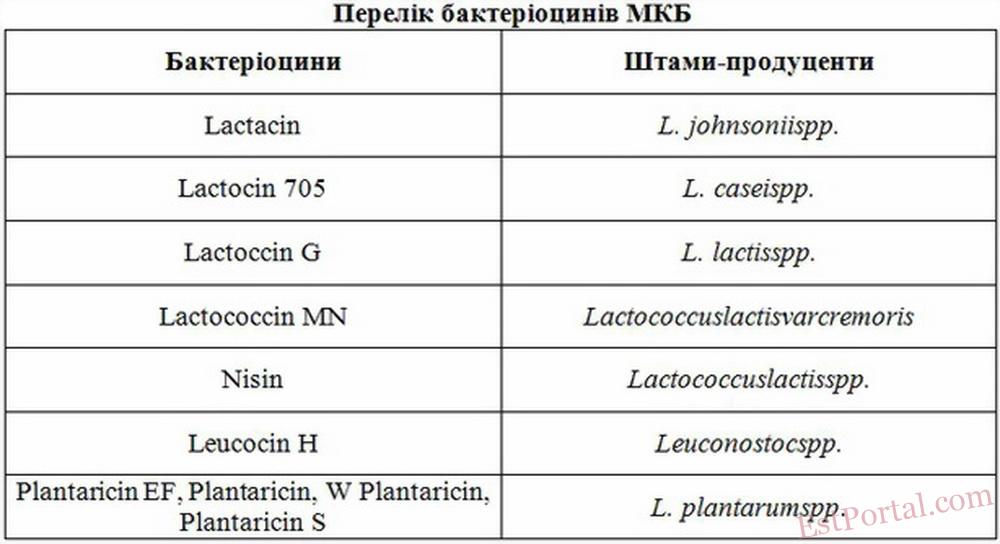
Найбільш поширені бактеріоцини наведені у таблиці 1.
Табл. 1.
Біосинтез та механізми стійкості до бактеріоцинів у МКБ
Як зазначалося вище, бактеріоцини – це рибосомальні пептиди, які піддаються посттрансляційній модифікації. Гени, що кодують ці пептиди, мають оперонну будову і можуть розташовуватись на транспозонах нуклеоїду чи на плазмідах. Бактеріоцини синтезуються в експоненційній фазі росту. Спочатку утворюються неактивні препептидні залишки, які включають N–термінальну затравку. Потім дана затравка піддається подальшій модифікації іншими амінокислотами чи їх похідними, які кодуються тими генами, що й затравка. Так, наприклад, тіоефірні комплекси лантіоніну і метиллантіоніну утворються з амінокислот дегідроаланіну і дегідробутирину, що є продуктами ферментативного дегідрування серину і треоніну відповідно. Тіоефірний зв’язок утворюється під час нуклеофільної атаки дегідроаланіну і дегідробутирину 2 молекулами цистеїну. Як затравка тут слугував попередньо утворений амінокислотний залишок з серину і треоніну. Цей біосинтетичний шлях характерний для продуцентів лантибіотиків.
Встановлено, що нелантибіотики синтезуються іншим чином, що зумовлено відсутністю посттрансляційної модифікації утвореного попередника (затравки). Наприклад, за синтез педіоцину відповідають комплекс генів pedA, pedB, pedC, pedD. Як і більшість представників 2 класу нелантибіотиків, педіоцин синтезується з препептиду, що містить подвійний залишок гліцину. Даний попередник кодується геном pedA. РedB відповідає за синтез протективних білків для захисту від токсичного впливу кінцевого педіоцину. РedC, pedD беруть участь у реалізації механізму вивільнення бактеріоцина з клітини (через АТФ-залежний комплекс).
Бактерії-продуценти бактеріоцинів мають якось себе захищати від токсичного ефекту свого власного бактеріоцина. Такий захист включає біосинтез протективних білків, які кодуються генами, що лежать на одному опероні разом із генами, що продукують даний бактеріоцин.
Виділяють два механізми захисту від негативного впливу бактеріоцинів на штами-продуценти, які характерні і для лантибіотиків, і для нелантобіотиків.
Перший полягає у синтезі відповідного протективного білка, який реагує з клітинними мішенями зв’язування бактеріоцинів і тим самим унеможливлює проникнення останнього у клітину.
Другий механізм пов’язаний зі структурними змінами АТФ-залежного транспортуючого комплексу, при яких даний комплекс працює тільки в одному напрямку – на експорт бактеріоцинів з клітини.
Механізм біологічної дії бактеріоцинів на сторонню мікрофлору
Механізм дії бактеріоцинів розглянемо на прикладі нізину. Грампозитивні бактерії мають у складі клітинної стінки високий вміст ліпотейхоєвих кислот. Нізин швидко зв’язується із глікозильними радикалами поверхневих ліпотейхоєвих кислот сильним ковалентним зв’язком, що супроводжується ліполітичною активністю приєднаного пептиду. Таким чином бактеріоцин інтегрує через клітинну стінку. Потім ковалентно зв’язується з ліпідом ІІ, що є попередником біліпідного шару мембрани. Це призводить до порушення просторової організації мембрано-ліпідного бішару і деполяризації трансмембранного електричного потенціалу. Внаслідок цього клітина не має більше змоги генерувати протонрушійну силу, синтезувати АТФ і починає втрачати корисні метаболіти та інші важливі низькомолекулярні речовини (вода, мінеральні солі). Таким чином клітина інактивується. Такий механізм біологічної дії притаманний майже всім бактеріоцинам. Але є деякі відхилення від даного механізму.
Так, наприклад, деякі нелантибіотики (лейкоцин, мезентеріцин) здатні блокувати манозно-фосфотрансферазну систему бактерій, тобто зв’язувати відповідні транспортуючі білки. Тому клітина втрачає здатність транспортувати і отримувати вуглеводи (манозу) у фосфорильованій формі. Це призводить до порушення метаболізму і витрат додаткової кількості АТФ на фосфорилювання в кіназних реакціях. Але деякі бактерії пристосувалися до такої дії бактеріоцинів. Наприклад, лейкоцин-резистентна L. monocytogenes здатна модифікувати відповідні транспортуючі білки, і вони перестають розпізнаватись лейкоцином. Але механізм таких реакцій поки що не встановлений.
Характеристика деяких бактеріоцинів та їх продуцентів
На біосинтез бактеріоцинів, як і інших біологічно активних речовин, впливають умови культивування продуцента: рН середовища, температура, а також час інкубації продуцента.
Ряд бактеріоцинів, які синтезуються молочнокислими бактеріями, вивчений досить докладно. Так, з Lactococcuslactis виділений і очищений бактеріоциндіацетин В-1, його молекулярна маса дорівнює 4300 Да. Первинна структура діацетину В-1 включає 37 амінокислотних залишків. Бактеріоцини (у тому числі діацетин В-1), які синтезуються 14 штамами L. lactis, виділеними з молока і молочних продуктів, мали широкий спектр дії, вони інгібували ріст як Listeriainnocua, так і інших видів лістерій, а також P. acidilactici, S. aureus, L. plantarum. Мутацин з Streptococcusmutans термостабільний, чутливий до протеолітичних ферментів, активний проти ряду грампозитивних бактерій, його молекулярна маса становить 3500 Да.
Штам Lactobacillusplantarum синтезує плантарицин, який володіє широким спектром дії, максимальний біосинтез якого відбувається на МПА з 0,6 % глюкози. Бактеріоцин термостабільний, має молекулярну масу 3500 Да, встановлена його амінокислотна послідовність.
Казеїцин, виділений з Lactobacilluscasei, утворюється при рості продуцента як у природному, так і в синтетичному середовищах.
Бактеріоцинаміловорин 471 продукується Lactobacillusamylovorus DCE 471 і може бути використаний у якості біоконсерванта харчових продуктів і кормів.
Лістерії, які розвиваються в харчових продуктах і приводять до їхнього псування, придушуються наступними бактеріоцинами: курвацином FS47, діацетином В-1, педіоцином, сакацином, ентерококцинами. Здатність до інгібування росту Listeria виявлена серед молочнокислих бактерій, що утворюють бактеріоцини: Lactobacillushetveticus, L. sake, Leuconostocgelidum.
В 1962 році було виділено бактеріоциноподібну речовину з ентерокока; вона мала широкий спектр антимікробної дії і була нетоксичною. Показано, що ентероцини (бактеріоцини з ентерококів) придушують розвиток інфекції при зараженні морських свинок Clostridiumsepticum.
Нізин – як найбільш розповсюджений бактеріоцин
Нізин – один з найбільш вивчених бактеріоцинів, його називають також поліпептидним антибіотиком, він відноситься до групи лантибіотиків і утворюється певними штамами L. lactis. Це мембранотропний поліпептид, що придушує ріст бактерій шляхом порушення утворення мембранного потенціалу. Вивчення механізму дії нізину привела до висновку, що мішенню для його дії служить саме цитоплазматична мембрана.
Нізин активний проти грампозитивних бактерій, включаючи високопатогенні та гнилисті бактерії S. aureusта L. monocytogenes. Містить у своєму складі 34 амінокислотних залишки і має пентациклічну форму з одним залишком лантіоніну і чотирма залишками метиллантіоніну. Природний варіант нізину, нізин Z, відрізняється від решти лише тим, що містить на 27 позиції, замість гістидину, аспарагін. Нізин може бути активним проти деяких патогенних бактерій навіть у наномолярних концентраціях, що залежить лише від фізіологічних особливостей цільових бактерій.
Даний бактеріоцин синтезується на рибосомах у вигляді попередника, що піддається подальшій модифікації. Утворений препептид є біологічно неактивним. Активація відбувається лише після набуття відповідної посттрансляційної конфігурації у вигляді пентациклу.
Нізин є термостабільним при 121 0С, але при тривалому перебуванні при цій температурі втрачає свою активність, особливо при рН 5-7. Як і інші бактеріоцини, він чутливий до дії трипсину, пепсину, карбоксипептидази, еластази. Ці властивості зумовлюють його безпечність у використанні в якості антимікробної добавки в харчових продуктах. У 1958 році Європейською комісією йому було присвоєно класифікаційний шифр Е 234, що відносить його до такого виду добавок як консерванти.
Казеїцин – новітній бактеріоцин
Більшість бактеріоцинів, в тому числі й нізин, поширюють свою інгібуючу дію на близькоспоріднені до штаму-продуцента види мікроорганізмів. Оскільки бактеріоцини продукуються грампозитивними МКБ, то й активність розповсюджується на грампозитивні патогенні і умовно-патогенні бактерії. Але серед патогенних видів мікроорганізмів, які викликають псування харчових продуктів, а також є джерелом бактеріальних інфекцій, виділяють грамнегативні Salmonelaта Listeriamonocytogenes, Escherichiacoli. Активність нізину проти зазначених грамнегативних мікроорганізмів невисока.
Нізин переважно інактивується в нейтральному чи лужному діапазоні значень рН, що унеможливлює його використання в нейтральних чи лужних продуктах харчування. Також негативно впливають на нізин ліпіди та фосфоліпіди (основна складова м’ясних виробів), які містяться переважно в продуктах тваринного походження. Все це суттєво обмежує сферу застосування нізину. Його використання виправдане тільки у нежирних кисломолочних продуктах (нежирний кефір, сир, простокваша) та пісних м’ясних виробах. Використання нізину в якості консерванта в кисломолочних продуктах недоцільне, тому що кисломолочні продукти є результатом життєдіяльності групи МКБ (закваска), які в результаті свого розвитку призводять до скисання молока і відповідно виділяють цілий ряд речовин з антимікробною активністю. Як вже зазначалося, серед них є і бактеріоцини. Особлива увага приділяється збереженню якості свіжих м’ясних виробів (свинина, баранина, яловичина, м’ясо кролів) та їх консервацій.
Одним із новітніх бактеріоцинів, який був виділений і очищений із жирного верблюжого молока (шубат) в одному із регіонів Китаю в 2013 році, є казеїцин. Продуцентом казеїцину є Lactobacilluscasei. Даний бактеріоцин характеризується широким спектром антимікробної дії на грампозитивні і грамнегативні мікроорганізми, що мають резистентність до деяких антибіотиків, зберігає активність не тільки в кислому середовищі, а й в нейтральному і лужному (pH 2.0–12.0), термостабільний (витримує 121 0С 20 хв.) і має вищу антимікробну активність порівняно з іншими бактеріоцинами.
Практичне застосування бактеріоцинів
На сьогоднішній день, бактеріоцини знайшли широке використання в різних галузях харчової промисловості: молочна, плодоовочева, м’ясна – в якості природних і безпечних консервантів.
Серед бактеріоцинів МКБ, для нізину А і його природного попередника нізину Z було доведено їхню антагоністичну активність по відношенню до бактерій, що спричиняють псування і гниття харчових продуктів. Більш того, нізин – єдиний бактеріоцин, дозволений до офіційного застосування в харчовій промисловості в багатьох країнах Європи (48 країн).
Для збереження якості харчових продуктів застосовується чимало методів: теплова обробка (пастеризація, теплова стерилізація), зменшення рН чи водної активності, додавання консервантів (антибіотики, органічні кислоти, хімічні консерванти). Але поряд з цими методами надається переваги застосуванню натуральних, безпечних, природних консервантів.
Бактеріоцини можуть бути застосовані в очищеній і неочищеній (концентрат) формах, а також введенням до складу продукту штама-продуцента даного бактеріоцина для його подальшого там накопичення (стартерна культура). Недолік стартерної культури полягає в тому, що склад продукту чи його кислотність можуть бути несприятливими для росту культури-продуцента, і, в такому разі, не буде накопичуватися достатній рівень бактеріоцину.
Було доведено вищу ефективність застосування бактеріоцинів в комбінації з іншими методами підвищення терміну зберігання харчових продуктів. Так, у випадку наявності грамнегативних патогенних бактерій у продукті, бактеріоцини переважно малоефективні (діють переважно на грампозитивні бактерії). Підвищити ефективність можна шляхом термічної обробки, або дією на продукт змінного електричного поля (не змінює органолептичні властивості продукту, на відміну від нагрівання), що поєднуються з введенням бактеріоцинів. В такому разі, при застосування даних технічних прийомів, клітинна стінка грамнегативних бактерій стає проникною для бактеріоцинів.
Також дію бактеріоцинів можна поєднувати з іншими антимікробними речовинами (натрію ацетат, натрію лактат), що призведе до збільшення ефективності дії природних консервантів.
Бактеріоцини також можуть бути задіяні у поліпшенні деяких смакових властивостей продукту, що досягається шляхом збільшення протеолітичної активності вільних ферментів, а також запобігання утворенню газового дефекту в твердих сирах.
Інше застосування бактеріоцинів – це біопакування харчових продуктів, при цьому стороння мікрофлора втрачає здатність проникати всередину продукту і викликати його псування. Відомо, що процес гниття продукту супроводжується ростом і розмноженням на його поверхні гнилистих мікроорганізмів, які викликають розкладання верхніх шарів продукту і таким чином потрапляють всередину. Запобігти цьому можна шляхом ізоляції продукту від зовнішнього середовища. Для цієї мети, бактеріоцини вводять до складу природних полімерів (білки сої, листя кукурудзи – теплове пресування) або штучних полімерів (метилцелюлоза, поліетилен, поліамід, полівінілхлорид, поліестер – адсорбція). Потім такими, насиченими бактеріоцином, плівками обгортають сировину, готові харчові продукти, і вони слугують природним бар’єром для потрапляння технічно шкідливої і гнилистої мікрофлори.
Висновки
- Молочнокислі бактерії в процесі свого розвитку утворюють ряд важливих речовин: молочна кислота, діацетил, перекис водню, леткі жирні кислоти, вуглекислий газ, специфічні білкові субстанції – бактеріоцини, які чинять бактеріостатичну чи бактерицидну дію на інші бактерії.
- Активний антагонізм молочнокислих бактерій зумовлений конкуренцією за ростові й енергетичні субстрати, дефіцитні ростові фактори, а також за природні місця існування.
- Бактеріоцини беруть активну участь у реалізації антагоністичної активності МКБ по відношенню до сторонньої мікрофлори.
- Бактеріоцини, на відміну від пептидних антибіотиків, є рибосомальними пептидами, термостабільні, інактивуються протеолітичними ферментами, але мають вужчий спектр антибактеріальної дії.
- За структурною будовою, механізмом біосинтезу і відношенню до температури бактеріоцини поділено на 3 класи: лантибіотики, нелантибіотики, і протеїнові бактеріоцини. Останні не мають широкого застосування через термолабільність.
- Механізм біологічної дії полягає у формуванні пор в клітинній стінці цільової бактерії, зміні структури мембрани та порушенні синтезу АТФ внаслідок розсіювання протонрушійної сили.
- Для дослідження антагоністичної активності МКБ застосовують методи insitu, invitro, invivo. Оскільки в процесі вивчення антагонізму потрібно враховувати всі фактори, що діють на чутливий штам, то надають перевагу методам insitu. Але такі методи потребують складну технічну реалізацію.
- Бактеріоцини (нізин) знайшли широке застосування в якості природних консервантів в м’ясних, молочних чи плодоовочевих продуктах. До складу харчових продуктів можуть вводитись у очищеній формі, у формі концентрату чи у вигляді стартерної культури.
Євгеній ЧАЙКА — біотехнолог