Ксеомин – препарат БТА, не содержащий комплексообразующих белков
В предисловии к этой статье хочется привести слова Stephen R. Tan и Richard G. Glogau, соавторов книги «Ботокс», которая стала настольным пособием для большинства косметологов всего мира: «Появление новых препаратов ботулотоксина типа А представляет собой наиболее значимое событие в этой области… Введение новых препаратов в практику требует сравнения каждого из них с эталонным ботулотоксином типа А. При оценке новых препаратов важно учитывать следующие факторы: количество белка/иммуногенность, длительность действия, характеристики диффузии, начало действия, аллергенность, стабильность и стоимость». Статья Юргена Фреверта, сотрудника компании Мерц Фармасьютикалз — производителя препарата Ксеомин (ботулинический токсин типа А) — даёт ответы на многие из этих вопросов. В настоящее время коррекция гиперфункциональных (мимических) морщин внесена в список официальных показаний к применению Ксеомина.
Ксеомин характеризуется самой высокой специфической активностью
Большой проблемой производства субстанции ботулинического токсина и готовых фармацевтических препаратов является сохранение специфической активности токсина. Обычно в процессе производства происходит инактивация до 90% нейротоксина, причём неактивная форма БТА действует по принципу токсоида (анатоксина). При производстве Ксеомина удаётся избежать разрушения активной субстанции. Поэтому он является единственным препаратом, который содержит только активную форму ботулинического нейротоксина типа А (с молекулярной массой 150 кДа) без примесей какого-либо другого белка бактериального происхождения. Методом электрофореза в полиакриламидном геле выявлено присутствие только лёгкой и тяжёлой цепей токсина.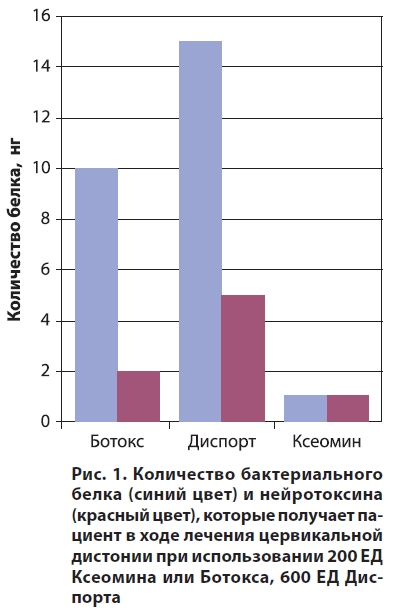
Сравним Ксеомин с другими аналогичными препаратами. Флакон с препаратом Ксеомин содержит 0,6 нг (600 пг) белка (это и есть, собственно, активная форма БТА), Ботокс — 5 нг, Диспорт — 12,5 нг, Миоблок (БТВ) — 55 нг, то есть кроме активной формы последние три препарата включают и дезактивированный нейротоксин. Если рассчитать специфическую активность, которая обозначает количество клостридиального белка на единицу ЛД50, то для Ксеомина она составит только 6 пг/ЕД, а для других препаратов — гораздо больше, например, для Ботокса — 50 пг/ЕД.
Что это означает для врача и в конечном счёте для пациента? Подсчитаем количество белка, которое получает пациент при лечении такой неврологической патологии, как спастическая кривошея, учитывая, что при этом используется 200 ЕД Ботокса/Ксеомина или 600 ЕД Диспорта (рис. 1). В случае применения Ксеомина пациент получает примерно 1 нг клостридиального белка, с другими же препаратами он получает гораздо больше чужеродного протеина. На сегодняшний день нет достоверных данных о полном составе сложных комплексов в различных коммерческих препаратах БТА, и потому точно неизвестно, какое количество активного нейротоксина в них содержится. Все эти расчёты основаны на том факте, что 1 ЕД Ботокса эквивалентна 1 ЕД Ксеомина. Но так ли это?
Активность и эффективность Ксеомина и Ботокса аналогичны
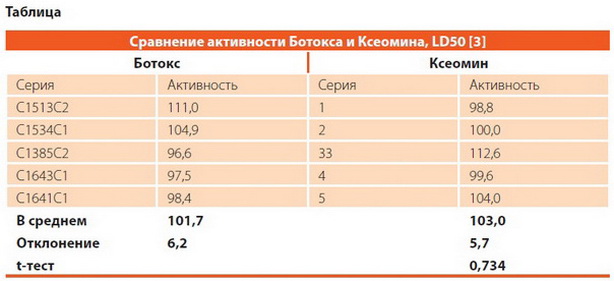
Mitchell Brin первым доказал эквивалентность единиц активности Ботокса и Ксеомина. Позже исследование на нескольких партиях коммерческих препаратов было выполнено Dressler D. и коллегами: как видно из таблицы, при сравнении ЛД50 какого-либо различия между препаратами не отмечается [3].
В клиническом исследовании с участием 460 пациентов, страдающих цервикальной дистонией, было показано, что в результате ботулинотерапии с применением Ксеомина симптомы заболевания уменьшились на 39% по шкале TWSTR (оценочная шкала спастической кривошеи Западного Торонто), с применением Ботокса — на 37%. Таким образом, оба препарата продемонстрировали одинаковую эффективность [1]. Этот результат сохранялся в течение всего периода терапевтического действия. Положительная динамика клинической картины и в том, и в другом случае отмечалась, начиная с 7-го дня после инъекций, уменьшение эффекта наблюдалось примерно через 10 недель после процедуры. Общая длительность терапевтического эффекта составила около 110 дней. При оценке данных по методу Каплана–Мейера видно, что какой-либо разницы между Ботоксом и Ксеомином не наблюдается. Аналогичные данные получены и в рандомизированном двойном слепом контролируемом исследовании с участием 300 пациентов, страдающих блефароспазмом [8]. Через 3 недели после процедуры ботулинотерапии уменьшение симптомов заболевания по шкале Jankovic для Ксеомина составило 2,9 балла, для Ботокса — 2,7. Различий в длительности терапевтического действия выявлено не было.
Таким образом, на основании проведённых клинических исследований установлено, что в лечении разных форм фокальной дистонии Ксеомин имеет ту же эффективность, что и Ботокс, и 1 ЕД Ксеомина эквивалентна 1 ЕД Ботокса [6].
Комплексообразующие белки не влияют на эффективность ботулинотерапии, однако обладают иммуностимулирующими свойствами
В состав большинства коммерческих препаратов входит комплекс БТА с гемагглютининами. Комплексообразующие белки обеспечивают стабильность токсина в желудочно-кишечном тракте; по другому предположению — способствуют его всасыванию. Пероральная токсичность чистого нейротоксина в 100 раз меньше, чем комплекса с гемагглютининами.
Возникает вопрос: почему комплексообразующие белки присутствуют в препаратах БТА? Их роль активно обсуждается в связи со стабильностью препарата, диффузией нейротоксина из места введения и, наконец, иммунным ответом.
Комплексообразующие белки потенциально способны оказывать иммуностимулирующее действие. Дело в том, что гемагглютинины относятся к группе лектинов — соединений, способных стимулировать иммунокомпетентные клетки. В экспериментальном исследовании 2006 г., проведённом группой японских специалистов, было показано, что гемагглютинины способствуют росту титра антител к ботулиническому нейротоксину при совместном присутствии. Одновременно повышался уровень и некоторых цитокинов [7]. Из этого можно сделать вывод о том, что гемагглютинины потенциально способны усиливать выработку антител к нейротоксину. Однако это — гипотеза, и есть только одно исследование с участием небольшого количества животных, в котором установлен факт формирования антител к БТА при применении Ботокса и отстутствие антител при применении Ксеомина.
Влияют ли комплексообразующие белки на диффузию нейротоксина?
Известно, что комплекс БТА с гемагглютининами стабилен только в кислой среде. С другой стороны, нейротоксин неактивен при pH=6, возможно, именно потому, что он находится внутри комплекса. При физиологических условиях (рН около 7) комплекс немедленно распадается с высвобождением активной формы токсина. Детальное изучение стабильности комплекса гемагглютинин — БТА было выполнено методом ионообменной хроматографии [4]. При pH=6 выявляется исключительно неповреждённый комплекс, при pH=6,75 наряду с комплексом обнаруживается как сам нейротоксин, так и комплексообразующие белки. При pH=7,2 комплекс диссоциирует на 90%, причём происходит это в течение одной минуты. Согласно этим данным, полученным в эксперименте in vitro, диффузия БТА в составе препаратов Ксеомин, Ботокс и Диспорт не должна существенно различаться. Что же происходит в реальной жизни, то есть в условиях in vivo? Существует несколько исследований, посвящённых изучению диффузии БТА в составе разных препаратов. L. Carli с коллегами с помощью иммунофлюоресцентного метода и вестерн-блоттинга проанализировали экспрессию молекул адгезии нервных клеток (N-CAM) в мышцах, прилегающих к месту инъекции: белок N-CAM экспрессируется только в денервированных мышцах. После инъекций препаратов Ботокс, Диспорт и Ксеомин N-CAM в соседних мышцах не обнаруживался, то есть отдалённая диффузия токсина во всех случаях отсутствовала [2]. Этот же факт был продемонстрирован в клинических исследованиях с участием 32 добровольцев [9]. После инъекций Ксеомина или Ботокса в короткий разгибатель пальцев стопы методом лектромиографии была подтверждена одинаковая фармакологическая эффективность препаратов. Уменьшения активности прилегающих мышц — мышцы, отводящей большой палец стопы (m. abductor hallucis), и мышцы, отводящей V палец стопы (m. abductor digiti quinti), — вследствие возможной диффузии токсина выявлено не было при всех использованных дозировках (вплоть до 32 ЕД).
Именно с диффузией токсина в соседние нецелевые мышцы связывают некоторые побочные эффекты ботулинотерапии. Если диффузия токсина в составе разных препаратов одинакова, то и побочные эффекты должны быть сопоставимы. В III фазе двух клинических исследований Ксеомина было установлено, что профиль побочных эффектов разных препаратов не отличался. Количество пациентов с дисфагией (самый распространённый побочный эффект ботулинотерапии) составило 10% для Ксеомина и 8% для Ботокса. При лечении блефароспазма Ботокс и Ксеомин показали аналогичный профиль побочных эффектов. Таким образом, можно сделать вывод о том, что диффузия токсина в составе Ксеомина или препаратов, содержащих его комплекс, существенно не отличается.
Ксеомин стабилен при хранении
Может быть, комплексообразующие белки необходимы для обеспечения стабильности нейротоксина при хранении?
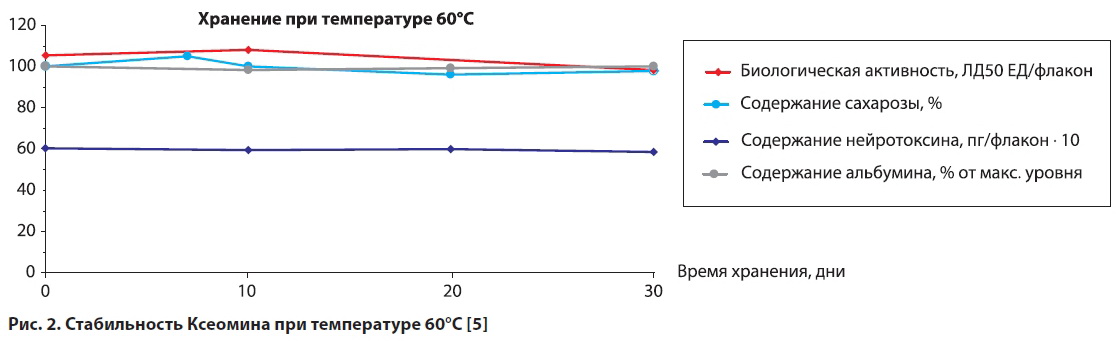
Проведённый S. Grein с коллегами эксперимент показал, что нейротоксин в составе препарата Ксеомин сохраняет свою активность в течение 30 дней при температуре 60°С (рис. 2) [5]. И даже при более высокой температуре — 70°C — Ксеомин сохранял стабильность в течение 3 дней.
Результаты целой серии исследований позволяют сделать вывод: Ксеомин в готовой лекарственной форме стабилен при комнатной температуре в течение 3 лет. По последним данным, препарат сохраняет активность даже в течение 4 лет.
Заключение
Специалистами компании Мерц (Merz) разработана технология производства активной и стабильной при хранении субстанции ботулинического токсина типа А, не содержащей неактивных клостридиальных и комплексообразующих белков. Эффективность препарата Ксеомин сопоставима с эффективностью Ботокса и других препаратов БТА. Безопасность применения чистого нейротоксина в составе Ксеомина не отличается от таковой при использовании препаратов, содержащих комплексообразующие белки.
Дискуссия
Вопрос (M. Zouhair Atassi): Большинство данных о стабильности было получено при изучении флакона с сублимированным препаратом. Как долго может храниться жидкая форма после восстановления?
Ответ (Jürgen Frevert): Восстановленный препарат должен храниться только 24 часа и обязательно при температуре 4°С, так как в ином случае могут возникнуть проблемы стерильности.
Вопрос: Вы всегда сравниваете Ксеомин с Ботоксом. Проводилось ли сравнительное изучение стабильности при 60°С?
Ответ: Подобного эксперимента мы ещё не проводили. Однако обязательно постараемся сделать это.
Вопрос: Мне кажется, вы не дали удовлетворительного ответа по проблеме антигенности. Вы процитировали работу, выполненную в 2006 году японской группой и опубликованную в журнале Microbiology. Но это исследование было очень спорным, и позднее в том же журнале я опубликовал критическую статью. Во-первых, использованная дозировка БТА была примерно в 1000 раз выше той, которую получает реальный пациент. Во-вторых, антиген, использованный для изучения иммунного ответа у мышей, в действительности являлся инактивированным токсином, обработанным формальдегидом, который значительно повышает антигенность белков. Даже белки, которые не являются антигенными по своей природе, после обработки формальдегидом проявляют высокоантигенные свойства. Примером этого феномена является цитохром, небольшая молекула которого приобретает свойства антигена после реакции с формальдегидом. Причина этого может заключаться в образовании с помощью перекрестных сшивок надмолекулярных комплексов. В своем следующем эксперименте японские исследователи изучали иммуногенные свойства гемагглютинина, «сшитого» с токсином с помощью формальдегида. Такой эксперимент не позволит сделать адекватные выводы, поскольку естественные комплексообразующие белки в составе лекарственных препаратов БТА не обрабатываются формальдегидом. Альбумин в присутствии формальдегида также становится более антигенным. По моему мнению, на это исследование не следует опираться.
Ответ: Приношу свои извинения за то, что в статье не обозначил точку зрения д-ра Z.Atassi. Я знаком с критической статьей в журнале Microbiology. Полагаю, что мы всегда и ко всему должны относиться критически, но всё же данные последних исследований позволяют нам говорить о наличии у гемагглютининов способности стимулировать образование антител. В последней работе японских специалистов описан эксперимент, в котором обработка формалином не проводилась, однако в присутствии гемагглютинина происходило повышение уровня антител к альбумину.
Вопрос: Формальдегид применяли всегда, за последние 50 лет это уже превратилось в традицию. И давно известно, что его использование увеличивает антигенность белков.
Ответ: Я это знаю, но в последнем эксперименте он не использовался.
Вопрос: Вы упомянули о биоэквивалентности Ксеомина и Ботокса. Это было обнаружено случайно или же препарат специально разрабатывался таким образом? Есть ли данные о сопоставлении активности Диспорта и Ксеомина?
Ответ: Как я понял, вы имеете в виду разработку Ксеомина?
Вопрос: Ксеомин позиционируется как эквивалент только одного препарата или же как независимый препарат, обладающий собственной особой эффективностью?
Ответ: Первоначальная идея была такова: из всего состава препарата нас интересовал только чистый и активный нейротоксин. Как мы уже знаем, комплексообразующие и другие белки в составе различных препаратов БТА играют лишь незначительную роль в плане эффективности терапевтического воздействия. Так возникла идея разработки продукта, не содержащего каких-либо других белков, только активный нейротоксин. Думаю, что у всех производителей имеются одинаковые штаммы клостридий, а конкретный штамм продуцирует нейротоксин с аналогичной специфической активностью. И очень важно не потерять эту активность в ходе производственного процесса.
Вопрос: Вы используете тот же штамм, что и производители Ботокса?
Ответ: Да.
Вопрос: Чем Диспорт отличается от вашего препарата?
Ответ: Отличия состава разных препаратов БТА обусловлены особенностями технологического процесса, в том числе стадии очищения. Andy Pickett продемонстрировал широкий спектр различных белков в составе Диспорта, и далеко не все они в действительности являются комплексообразующими. При производстве Ксеомина исключено использование комплексообразующих белков, которые не оказывают существенного влияния на клиническую эффективность препарата.
Литература:
- Benecke R., Jost W.H., Kanovsky P., Ruzicka E., Comes G., Grafe S. A new botulinum toxin type A free of complexing proteins for treatment of cervical dystonia. Neurology. 2005: 11: 1949–1951.
- Carli L., Montecucco C., Rossetto O. An histological assessment of diff usion of diff erent botulinum neurotoxin type A formulations injected in the mice leg. Toxicon. 2008; 51 (Suppl. 1): 9.
- Dressler D., Mander G.J., Fink K. Equivalent potency of Xeomin and BOTOX. Toxicon. 2008; 51 (Suppl. 1): 10.
- Eisele K.-H., Taylor H.V. Dissociation of the 900 kDa neurotoxin complex from Cl. botulinum under physiological conditions. Toxicon. 2008; 51 (Suppl. 1): 10.
- Grein S., Gerd J., Mander G.J., Taylor H.V. Xeomin is stable without refrigeration: complexing proteins are not required for stability of botulinum neurotoxin type A preparations. Toxicon. 2008; 51 (Suppl. 1): 13.
- Jost W.H., Blumel J., Grafe S. Botulinum neurotoxin type A free of complexing proteins (XEOMIN) in focal dystonia. Drugs. 2007; 67: 669–683.
- Lee J.C., Yokota K., Arimitsu H. et al. Production of anti-neurotoxin antibody is enhanced by two subcomponents, HA1 and HA3b, of Clostridium botulinum type B 16S toxin-haemagglutinin. Microbiology. 2005; 151; 3739–3747.
- Roggenkamper P., Jost W.H., Bihari K., Comes G., Grafe S. Effi cacy and safety of a new Botulinum ToxinType A free of complexing proteins in the treatment of blepharospasm. J. Neural Transm. 2006; 113:303–312.
- Wohlfarth K., Muller C., Sassin I., Comes G., Grafe S. Neurophysiological double-blind trial of a botulinum neurotoxin type a free of complexing proteins. Clin. Neuropharmacol. 2007; 30: 86–94.
Юрген ФРЕВЕРТ (Jürgen Frevert) — Мерц Фармасьютикалз (Германия)
Статья опубликована в журнале Toxicon. 2009; 54: 697–701
По материалам «Инъекционные методы в косметологии» №3-2010