Розацеа: обновление медикаментозной терапии
Розацеа является распространённым хроническим дерматозом, в первую очередь поражающим центральную часть лица, в том числе щёки, нос, глаза, подбородок и лоб.1 Первичные кожные проявления включают чувствительную кожу, устойчивую эритему, папулы, пустулы и телеангиэктазии. Хотя выраженность симптомов может уменьшаться на непродолжительное время, в долгосрочной перспективе у большинства пациентов дерматоз склонен к медленному прогрессирующему течению.2
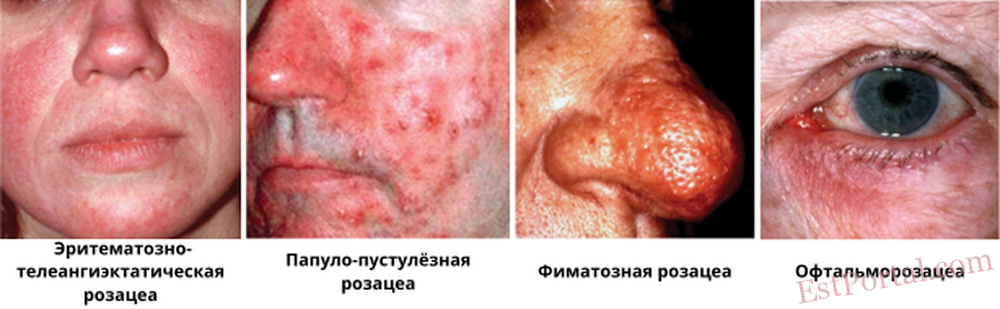
Национальный комитет по розацеа подразделяет розацеа на четыре основных подтипа:
- эритематозно-телеангиэктатический;
- папулёзно-пустулёзный;
- фиматозный;
- офтальмологический.3
Возможна трансформация одного подтипа в другой.4 Правильное определение подтипов может помочь в выборе терапевтической стратегии.
Розацеа затрагивает до 10% от общей численности населения и дебютирует, как правило, в возрасте 30-50 лет.5 Дерматоз особенно распространён среди светлокожих лиц северного европейского происхождения.6 Чаще встречается у женщин,5 но мужчины более склонны к развитию инфильтрированных и фимозных изменений кожи, особенно в области носа.
Патофизиология является многофакторной и в настоящее время до конца не изучена. Было предложено множество факторов, претендующих на этиологическую роль, в том числе сосудистые аномалии, желудочно-кишечные расстройства, дегенерация матрицы, аномалии сальных желёз, микробная активность и изменение врождённого иммунного ответа.8,9
Розацеа может вызывать психологические расстройства, например, смущение, тревогу и низкую самооценку, которые отрицательно влияют на качество жизни. Эти негативные последствия должны быть приняты во внимание при лечении больных розацеа.10,11 Консервативные меры, такие как предотвращение обострений, надлежащий уход за кожей, а также использование маскирующей косметики и фотозащиты также должны включаться в план лечения.12
Обычные методы лечения
Топический метронидазол
Метронидазол в качестве эффективного средства при розацеа впервые был применён в 1980 году.13 Несмотря на то, что метронидазол является антибактериальным и антипротозойным агентом, терапевтические преимущества метронидазола при розацеа в основном получены за счёт его противовоспалительных и антиоксидантных свойств.14 Несколько исследований показали, что топический метронидазол значительно уменьшает количество воспалительных поражений и покраснение, по сравнению с плацебо, как правило, хорошо переносится, имеет низкий уровень побочных эффектов и является эффективным в поддержании ремиссии.15-18
Важно отметить, что различные композиции метронидазола, независимо от типа транспортного средства (крем, гель или лосьон) или концентрации (0,75% или 1%)19-21 имеют сходную эффективность. Однократное суточное использование метронидазола оказалось так же эффективно, как двукратное.19,22 Кроме того, в сочетании с солнцезащитным кремом с SPF 15 метронидазол может снижать развитие телеангиэктазий на лице.23 Следует отметить, что топический метронидазол при использовании у беременных отнесён к лекарствам категории B.
Топическая азелаиновая кислота
Азелаиновая кислота является естественной дикарбоновой кислотой, утверждённой в последнее десятилетие для лечения лёгкой и умеренной розацеа.24 В основном применяемая в виде 15% геля или 20% крема, азелаиновая кислота оказывает лечебный эффект за счёт своего противовоспалительного, антикератолитического и антибактериального действия.24 Несколько исследований показали, что азелаиновая кислота является более эффективной, чем плацебо в снижении количества воспалительных элементов и степени эритемы.25-27
Объединённые показатели у пациентов, имеющих заметное улучшение при лечении азелаиновой кислотой были 70-80%, по сравнению с 50-55% в группе плацебо.28 Азелаиновая кислота также имеет относительно низкую частоту побочных эффектов, из которых наиболее часто сообщалось о жжении, покалывании и раздражении.26 Частота побочных эффектов больше у азелаиновой кислоты по сравнению с метронидазолом, но эти эффекты, как правило, мягкие и кратковременные.29
Несмотря на то, что обычный режим применения азелаиновой кислоты — дважды в день, было обнаружено, что применение один раз в день было эффективным в равной степени.30 Необходимы дальнейшие исследования, чтобы изучить использование азелаиновой кислоты в качестве поддерживающей терапии.28 При использовании у беременных азелаиновая кислота включена в категорию B лекарств.
Тетрациклины
Использование в качестве эффективного лечения розацеа не по прямому назначению пероральных антибиотиков было признано более 50 лет. Терапевтические преимущества тетрациклинов при розацеа в основном обусловлены их противовоспалительным, а не антибактериальным механизмом, так как нет достаточных доказательств в пользу роли бактериальной инфекции в патогенезе заболевания.31 Антибиотики тетрациклинового ряда особенно показаны при офтальморозацеа, которая обычно встречается у более, чем 50% пациентов с розацеа.
Тетрациклины, которые противопоказаны беременным женщинам, наиболее часто используемый класс антибиотиков, являющийся наиболее эффективным при воспалительных папулах и пустулах.
Тетрациклины второго поколения, в том числе миноциклин и в частности доксициклин, особенно безопасны и эффективны при пероральном лечении розацеа. В отличие от тетрациклина они имеют большую биодоступность,32 быстрое начало действия, и могут приниматься с пищей, которая сводит к минимуму желудочно-кишечные побочные эффекты. Кроме того, тетрациклины второго поколения требуют только однократного приёма в сутки, что может улучшить комплаентность у пациентов. Самое главное, они эффективны при субантимикробной дозе, что позволяет избежать отрицательного воздействия на эндогенную флору и, главное, распространения резистентности к противомикробным препаратам.33
В недавних клинических испытаниях33 было показано, что субантимикробные дозы доксициклина в суточной дозе 40 мг у пациентов с умеренной и тяжёлой розацеа значительно снижали количество воспалительных папул и пустул по сравнению с плацебо после 16 недель лечения со значительным улучшением, наблюдавшимся на 3 неделе. Распространённость побочных эффектов была низкой и лишь незначительно выше, чем плацебо. Из побочных эффектов наиболее частыми были назофарингит (4,8%), диарея (4,4%) и головные боли (4,4%). При этом не было ни одного случая фотосенсибилизации или вагинального кандидоза.
Отдельное исследование показало, что эффективность при лечении розацеа 40 мг доксициклина сравнима с 100 мг доксициклина.34 Субантимикробная доза 40 мг доксициклина для лечения розацеа одобрена в США и Канаде. В отличие от этого, миноциклин не одобрен, так как по сравнению с доксициклином оказывает в пять раз больше побочных эффектов, среди которых гиперпигментация, гепатотоксичность и индуцированная им волчанка.35
Необходимы дальнейшие исследования по эффективности комбинированной терапии субантимикробными дозами доксициклина и топического метронидазола, при которой отмечалось более быстрое начало действия и более быстрый регресс воспалительных высыпаний по сравнению с монотерапией метронидазолом.36
Новые и недавно появившиеся методы терапии
Топический ивермектин
Несколько топических акарицидных средств (перметрин 5%, кротамитон 10% и ивермектин 1%) были изучены в качестве препаратов для лечения розацеа. Все они в первую очередь способны воздействовать на клещей Demodex folliculorum и Demodex brevis. Потенциал этиологической роли этих клещей в розацеа обсуждается уже много лет.9 Существует возрождение интереса к клещам в связи с недавними исследованиями, которые показали, что антигенные белки, вырабатываемые синергичной клещу бактерией (Bacillus oleronius), могут усугублять воспалительные реакции при папулёзно-пустулёзной, эритематозно-телеангиэктатической38 и глазной формах розацеа.37 Этот патогенный сценарий, к которому причастны бактерии Bacillus oleronius, а не сами по себе клещи, позволяет объяснить эффект от антибактериальных препаратов при розацеа.
Были опубликованы многочисленные сообщения39-41 о случаях успешного лечения розацеа топическими акарицидными препаратами, однако не хватает данных контролируемых рандомизированных исследований. В настоящее время проводится 3 фаза рандомизированных клинических исследований, изучающих эффективность и безопасность 1% крема ивермектина в сравнении с эффективностью и безопасностью 0,75% крема метронидазола и 15% геля азелаиновой кислоты при розацеа.42-44 Результаты, как ожидается, будут доступны в ближайшее время.
Топический бримонидин и оксиметазолин
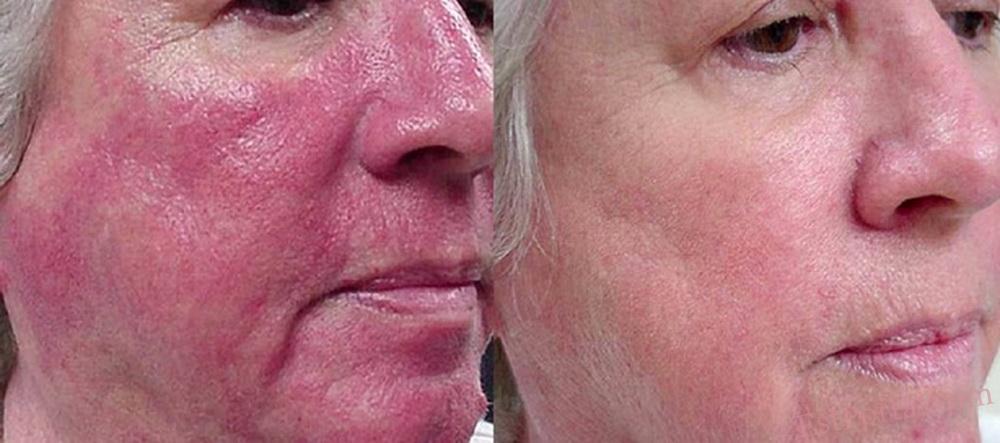
Диффузная и стойкая эритема лица уже давно представляет собой клиническую проблему в терапии розацеа.5 Одним из факторов эритемы лица являются аномальные вазомоторные кожные реакции, что приводит к расширению поверхностных кровеносных сосудов лица.45 Реакция кровеносных сосудов на вазоактивные стимулы пробудила интерес к изучению агонистов α2-адренергических рецепторов в качестве терапевтических агентов, устраняющих эритему.45
Бримонидин тартрат 0,33% гель — утверждён FDA США в августе 2013 года и Министерством здравоохранения Канады в феврале 2014 года, является последним дополнением к арсеналу лечения розацеа и первым топическим препаратом, утверждённым для лечения эритемы лица при розацеа. Бримонидин (изначально доступный в форме глазных капель для лечения глаукомы), является высоко селективным агонистом α2-адренергических рецепторов с мощной сосудосуживающей активностью.46
Было установлено, что 4-недельная терапия розацеа 0,5% гелем бримонидин тартрат, назначавшимся один раз в день, по своей эффективности значительно превосходила эффект плацебо.47 Наблюдалось заметное улучшение уже через 30 минут после первого применения. Побочные явления были умеренно выражены, чаще в виде эритемы (5,1%), зуда (5,0%), раздражения кожи (1,2%), и ухудшения течения розацеа (1,1%). Не отмечено тахифилаксии, синдрома отмены. Кроме того, недавно были опубликованы данные из 12-месячного многоцентрового, открытого исследования об устойчивой эффективности, без тахифилаксии при длительном лечении умеренной и тяжелой эритемы розацеа.48
Недавно была завершена 2 фаза клинических испытаний другого перспективного агониста α-адренорецепторов оксиметазолина.49 Результаты должны быть доступны в ближайшее время.
Другие методы лечения
Топический 10% сульфацетамид натрия с 5% содержанием серы
Топический 10% сульфацетамид натрия с 5% содержанием серы используется более 50 лет в лечении розацеа, хотя механизм его действия не очень хорошо понятен. В 8-недельном исследовании, Сульфацетамид 10% с содержанием серы 5%, как было показано значительно уменьшал воспалительные поражения (78% против 18%) и выраженность эритемы лица (83% против 31%, р<0,001) по сравнению с плацебо (основа препарата).50 Однако исследования, оценивающие эту терапию, ограничены и в целом низкого качества.28
Оральный изотретиноин
Оральный изотретиноин может использоваться не по прямому назначению для лечения более тяжёлых или стойких случаев папулёзно-пустулёзной розацеа, и может помочь замедлить или остановить прогрессирование ринофимы.
В 12-недельном исследовании сравнения эффективности различных доз изотретиноина, доксициклина и плацебо в лечении розацеа изотретиноин в дозе 0,3 мг/кг продемонстрировал не меньшую, чем у доксициклина эффективность и хорошо переносился.51 Однако изотретиноин следует назначать только при тщательном мониторинге, и особенно у женщин детородного возраста, соответствующая стратегия контрацепции имеет важное значение в связи с его тератогенным потенциалом.
Лазерные и световые методы лечения
Лазерные и световые методы лечения были успешно использованы в течение многих лет для лечения сосудистых проявлений розацеа. В рандомизированных исследованиях импульсный лазер на красителе и интенсивные методы импульсного света были признаны эффективными с одинаковой эффективностью в снижении эритемы и телеангиэктазий у пациентов с эритематозно-телеангиэктатической розацеа.52
Топический пероксид бензоила и клиндамицин
В 12-недельном клиническом исследовании53 у пациентов с розацеа с использованием 5% топического пероксида бензоила и 1% клиндамицина один раз в день была показана их значительная эффективность в виде уменьшения папулёзно-пустулёзных высыпаний по сравнению с эффектом в группе плацебо, получавших основу препарата (71,3% против 19,3%, р=0,0056). Нежелательные явления были лишь слегка выше в группе лечения, наиболее частыми из которых являлись жжение и зуд.
Топический пимекролимус
Эффективность и хорошую переносимость в лечении розацеа продемонстрировал в недавнем исследовании 1% крем пимекролимус.54 Побочные эффекты были краткосрочными и мягкими, включавшими местное жжение, зуд, сухость и покалывание.
Заключение
Есть множество вариантов лечения розацеа, однако применение только некоторых препаратов поддерживается качеством научных исследований. Если это возможно, то в терапевтическом процессе принятия решения об использовании метода лечения розацеа врач должен руководствоваться прежде всего высоким уровнем доказательств и рядом факторов, таких как подтип розацеа, тяжесть дерматоза, ожидания от лечения, переносимость, стоимость и предшествующая реакция на терапию.
Топические азелаиновая кислота и метронидазол считаются безопасными и эффективными методами лечения первого ряда. Использование субантимикробных доз доксициклина подкреплено основательными исследованиями и может быть использовано для лечения от умеренных до тяжёлых форм папулёзно-пустулёзной или глазной розацеа. Низкие дозы изотретиноина или хирургические вмешательства могут быть применены при фиматозном типе розацеа. Лазерная терапия может с успехом использоваться в лечении телеангиэктатического компонента розацеа. Новый метод терапии — бримонидин, показан для лечения диффузной эритемы лица при розацеа. Комплексный план лечения должен также включать немедикаментозные стратегии, направленные на улучшение качества жизни, меры по профилактике обострений, осуществление надлежащего ежедневного ухода за кожей, камуфляжную терапию и фотозащиту.
Необходимы дальнейшие исследования по эффективности комбинированной терапии, изотретиноина, сульфацетамида и вновь создаваемых препаратов в сравнении с обычными методами лечения.
Литература:
- Crawford GH, Pelle MT, James WD. Rosacea: I. Etiology, pathogenesis, and subtype classification. J Am Acad Dermatol. 2004 Sep; 51(3):327-41; quiz 42-4.
- Powell FC. Clinical practice. Rosacea. N Engl J Med. 2005 Feb 24; 352(8):793-803.
- Wilkin J, Dahl M, Detmar M, et al. Standard grading system for rosacea: report of the National Rosacea Society Expert Committee on the classification and staging of rosacea. J Am Acad Dermatol. 2004 Jun; 50(6):907-12.
- Wilkin J, Dahl M, Detmar M, et al. Standard classification of rosacea: report of the National Rosacea Society Expert Committee on the classification and staging of rosacea. J Am Acad Dermatol. 2002 Apr; 46(4):584-7.
- Gupta AK, Chaudhry MM. Rosacea and its management: an overview. J Eur Acad Dermatol Venereol. 2005 May; 19(3):273-85.
- Jansen T, Plewig G. Rosacea: classification and treatment. J R Soc Med. 1997 Mar; 90(3):144-50.
- Tan J, Berg M. Rosacea: current state of epidemiology. J Am Acad Dermatol. 2013 Dec; 69(6 Suppl 1):S27-35.
- Gallo R, Drago F, Paolino S, et al. Rosacea treatments: What's new and what's on the horizon? Am J Clin Dermatol. 2010; 11(5):299-303.
- Layton A, Thiboutot D. Emerging therapies in rosacea. J Am Acad Dermatol. 2013 Dec; 69(6 Suppl 1):S57-65.
- Aksoy B, Altaykan-Hapa A, Egemen D, et al. The impact of rosacea on quality of life: effects of demographic and clinical characteristics and various treatment modalities. Br J Dermatol. 2010 Oct; 163(4):719-25.
- Wolf JE, Jr., Del Rosso JQ. The CLEAR trial: results of a large community-based study of metronidazole gel in rosacea. Cutis. 2007 Jan; 79(1):73-80.
- Gooderham M. Rosacea and its topical management. Skin Therapy Lett. 2009 Feb; 14(2):1-3.
- Nielsen PG. Treatment of rosacea with 1% metronidazole cream. A doubleblind study. Br J Dermatol. 1983 Mar; 108(3):327-32.
- Narayanan S, Hunerbein A, Getie M, et al. Scavenging properties of metronidazole on free oxygen radicals in a skin lipid model system. J Pharm Pharmacol. 2007 Aug; 59(8):1125-30.
- Dahl MV, Katz HI, Krueger GG, et al. Topical metronidazole maintains remissions of rosacea. Arch Dermatol. 1998 Jun; 134(6):679-83.
- Breneman DL, Stewart D, Hevia O, et al. A double-blind, multicenter clinical trial comparing efficacy of once-daily metronidazole 1 percent cream to vehicle in patients with rosacea. Cutis. 1998 Jan; 61(1):44-7.
- Bleicher PA, Charles JH, Sober AJ. Topical metronidazole therapy for rosacea. Arch Dermatol. 1987 May; 123(5):609-14.
- Rowe-Jones DC, Peel AL, Kingston RD, et al. Single dose cefotaxime plus metronidazole versus three dose cefuroxime plus metronidazole as prophylaxis against wound infection in colorectal surgery: multicentre prospective randomised study. BMJ. 1990 Jan 6; 300(6716):18-22.
- Yoo J, Reid DC, Kimball AB. Metronidazole in the treatment of rosacea: do formulation, dosing, and concentration matter? J Drugs Dermatol. 2006 Apr; 5(4):317-9.
- Maddin S. A comparison of topical azelaic acid 20% cream and topical metronidazole 0.75% cream in the treatment of patients with papulopustular rosacea. J Am Acad Dermatol. 1999 Jun;40(6 Pt 1):961-5.
- Dahl MV, Jarratt M, Kaplan D, et al. Once-daily topical metronidazole cream formulations in the treatment of the papules and pustules of rosacea. J Am Acad Dermatol. 2001 Nov; 45(5):723-30.
- Jorizzo JL, Lebwohl M, Tobey RE. The efficacy of metronidazole 1% cream once daily compared with metronidazole 1% cream twice daily and their vehicles in rosacea: a double-blind clinical trial. J Am Acad Dermatol. 1998 Sep; 39(3):502-4.
- Tan JK, Girard C, Krol A, et al. Randomized placebo-controlled trial of metronidazole 1% cream with sunscreen SPF 15 in treatment of rosacea. J Cutan Med Surg. 2002 Nov-Dec; 6(6):529-34.
- Fitton A, Goa KL. Azelaic acid. A review of its pharmacological properties and therapeutic efficacy in acne and hyperpigmentary skin disorders. Drugs. 1991 May; 41(5):780-98.
- Thiboutot D, Thieroff-Ekerdt R, Graupe K. Efficacy and safety of azelaic acid (15%) gel as a new treatment for papulopustular rosacea: results from two vehicle-controlled, randomized phase III studies. J Am Acad Dermatol. 2003 Jun; 48(6):836-45.
- Carmichael AJ, Marks R, Graupe KA, et al. Topical azelaic acid in the treatment of rosacea. J Dermatolog Treat. 1993; 4(suppl):S19-S22.
- Bjerke R, Fyrand O, Graupe K. Double-blind comparison of azelaic acid 20% cream and its vehicle in treatment of papulo-pustular rosacea. Acta Derm Venereol. 1999 Nov; 79(6):456-9.
- van Zuuren EJ, Kramer S, Carter B, et al. Interventions for rosacea. Cochrane Database Syst Rev. 2011(3):CD003262.
- Colon LE, Johnson LA, Gottschalk RW. Cumulative irritation potential among metronidazole gel 1%, metronidazole gel 0,75%, and azelaic acid gel 15%. Cutis. 2007 Apr; 79(4):317-21.
- Thiboutot DM, Fleischer AB, Jr., Del Rosso JQ, et al. Azelaic acid 15% gel once daily versus twice daily in papulopustular rosacea. J Drugs Dermatol. 2008 Jun; 7(6):541-6.
- Pelle MT, Crawford GH, James WD. Rosacea: II. Therapy. J Am Acad Dermatol. 2004 Oct; 51(4):499-512; quiz 3-4.
- Maibach H. Second-generation tetracyclines, a dermatologic overview: clinical uses and pharmacology. Cutis. 1991 Nov; 48(5):411-7.
- Del Rosso JQ, Webster GF, Jackson M, et al. Two randomized phase III clinical trials evaluating anti-inflammatory dose doxycycline (40-mg doxycycline, USP capsules) administered once daily for treatment of rosacea. J Am Acad Dermatol. 2007 May; 56(5):791-802.
- Del Rosso JQ, Schlessinger J, Werschler P. Comparison of anti-inflammatory dose doxycycline versus doxycycline 100 mg in the treatment of rosacea. J Drugs Dermatol. 2008 Jun; 7(6):573-6.
- Smith K, Leyden JJ. Safety of doxycycline and minocycline: a systematic review. Clin Ther. 2005 Sep; 27(9):1329-42.
- Sanchez J, Somolinos AL, Almodovar PI, et al. A randomized, double-blind, placebo-controlled trial of the combined effect of doxycycline hyclate 20-mg tablets and metronidazole 0.75% topical lotion in the treatment of rosacea. J Am Acad Dermatol. 2005 Nov; 53(5):791-7.
- Lacey N, Delaney S, Kavanagh K, et al. Mite-related bacterial antigens stimulate inflammatory cells in rosacea. Br J Dermatol. 2007 Sep; 157(3): 474-81.
- O'Reilly N, Menezes N, Kavanagh K. Positive correlation between serum immunoreactivity to Demodex-associated Bacillus proteins and erythematotelangiectatic rosacea. Br J Dermatol. 2012 Nov; 167(5):1032-6.
- Allen KJ, Davis CL, Billings SD, et al. Recalcitrant papulopustular rosacea in an immunocompetent patient responding to combination therapy with oral ivermectin and topical permethrin. Cutis. 2007 Aug; 80(2):149-51.
- Forstinger C, Kittler H, Binder M. Treatment of rosacea-like demodicidosis with oral ivermectin and topical permethrin cream. J Am Acad Dermatol. 1999 Nov; 41(5 Pt 1):775-7.
- Karincaoglu Y, Bayram N, Aycan O, et al. The clinical importance of demodex folliculorum presenting with nonspecific facial signs and symptoms. J Dermatol. 2004 Aug; 31(8):618-26.
- Galderma. Randomized, double-blind, parallel-group, vehicle-controlled, dose-finding study investigating the pharmacodynamics and safety of three concentrations of CD07805/47 topical gel (0,07%, 0,18%, and 0,50%), applied in subjects with moderate to severe erythematotelangiectatic rosacea. In: ClinicalTrials.gov, Identifier: NCT00989014. Last updated September 19, 2013. Available at: http://clinicaltrials.gov/ct2/show/NCT00989014. Accessed: March 9, 2014.
- Galderma. A phase 3 randomized, double blind, 12 week vehicle controlled, parallel group study assessing the efficacy and safety of CD5024 1% cream versus vehicle cream in subjects with papulopustular rosacea, followed by a 40 week investigator blinded extension comparing the long term safety of CD5024 1% cream versus azelaic Acid 15% gel. In: ClinicalTials.gov, Identifier: NCT01493687. Last updated January 27, 2014. Available at: http://clinicaltrials.gov/ct2/show/NCT01493687?term=NCT01493687&rank=1. Accessed: March 10, 2014.
- Galderma. Efficacy and safety of CD5024 1% cream versus metronidazole 0.75% cream in subjects with papulopustular rosacea over 16 weeks treatment, followed by a 36-week extension period (ATTRACT).In: ClinicalTrials.gov, Identifier: NCT01493947. Last updated December 20, 2013. Available at: http://clinicaltrials.gov/ct2/show/NCT01493947?term=NCT01493947&rank=1. Accessed: March 9, 2014.
- Del Rosso JQ. Advances in understanding and managing rosacea: part 2: the central role, evaluation, and medical management of diffuse and persistent facial erythema of rosacea. J Clin Aesthet Dermatol. 2012 Mar; 5(3):26-36.
- Rahman MQ, Ramaesh K, Montgomery DM. Brimonidine for glaucoma. Expert Opin Drug Saf. 2010 May; 9(3):483-91.
- Fowler J. Jr., Jackson M, Moore A, et al. Efficacy and safety of once-daily topical brimonidine tartrate gel 0.5% for the treatment of moderate to severe facial erythema of rosacea: results of two randomized, double-blind, and vehiclecontrolled pivotal studies. J Drugs Dermatol. 2013 Jun 1; 12(6):650-6.
- Moore A, Kempers S, Murakawa G, et al. Long-term safety and efficacy of once-daily topical brimonidine tartrate gel 0.5% for the treatment of moderate to severe facial erythema of rosacea: results of a 1-year open-label study. J Drugs Dermatol. 2014 Jan; 13(1):56-61.
- Allergan. Safety and tolerability of AGN-199201 in patients with erythema associated with rosacea. In: Clinical Trials.gov, Identifier: NCT01579084. Last updated September 12, 2013. Available at: http://clinicaltrials.gov/ct2/show/NCT01579084?term=NCT01579084&rank=1. Accessed: March 10, 2014.
- Sauder DN, Miller R, Gratton D, et al. The treatment of rosacea: the safety and efficacy of sodium sulfacetamide 10% and sulfur 5% lotion (Novacet) is demonstrated in a double-blind study. J Dermatolog Treat. 1997; 8(2):79-85.
- Gollnick H, Blume-Peytavi U, Szabo EL, et al. Systemic isotretinoin in the treatment of rosacea — doxycycline- and placebo-controlled, randomized clinical study. J Dtsch Dermatol Ges. 2010 Jul; 8(7):505-15.
- Neuhaus IM, Zane LT, Tope WD. Comparative efficacy of nonpurpuragenic pulsed dye laser and intense pulsed light for erythematotelangiectatic rosacea. Dermatol Surg. 2009 Jun; 35(6):920-8.
- Breneman D, Savin R, VandePol C, et al. Double-blind, randomized, vehiclecontrolled clinical trial of once-daily benzoyl peroxide/clindamycin topical gel in the treatment of patients with moderate to severe rosacea. Int J Dermatol. 2004 May; 43(5):381-7.
- Kim MB, Kim GW, Park HJ, et al. Pimecrolimus 1% cream for the treatment of rosacea. J Dermatol. 2011 Dec; 38(12):1135-9.
ЧАНГ Б., КУРЬЯН А. — Университет Альберта, Эдмонтон (Канада)
БАРАНКИН Б. — Дерматологический центр Торонто (Канада)