Полюби свои жировые клетки!
Всем известен «стандарт» женской красоты — 90–60–90. Особенно «пугающей» цифрой из этой тройки кажется 60, а именно — обхват талии. Для достижения желанных 40 кг многие девушки сидят на жёстких диетах, ограничивают себя в еде и радуются каждому ушедшему килограмму. Стоп, девушки! Остановитесь! Ведь недавнее открытие показало — клетки, присутствующие в жировой ткани, важны для иммунитета и защищают нас от инфекций (в частности, от золотистого стафилококка).
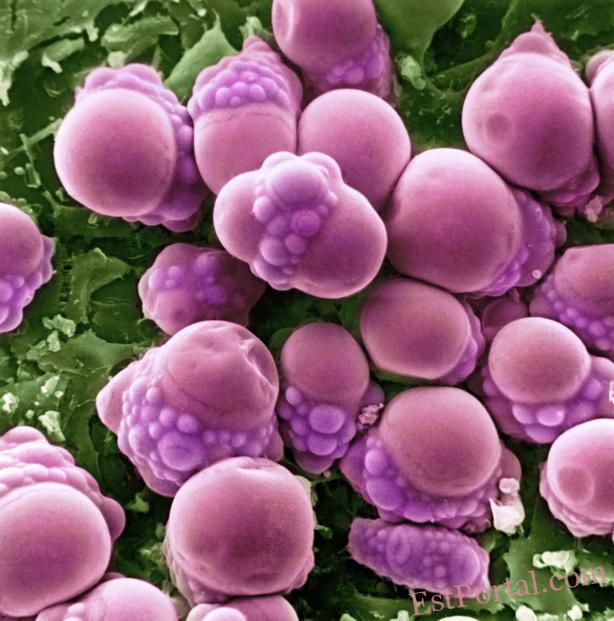
Из чего состоит наша жировая ткань? Основная масса клеток, составляющих её — это адипоциты, или жировые клетки (рис. 1). Жировая ткань широко распространена в организме: в норме на неё приходится около 15-20 % массы тела у мужчин и 20-25 % — у женщин. Различают два вида жировой ткани — белую и бурую. Адипоциты выполняют множество функций: накапливая жиры, играют роль энергетических резервуаров; обеспечивают теплоизоляцию и защиту органов от механических повреждений; участвуют в эндокринной регуляции.
Рис. 1. Жировые клетки — адипоциты.
Ранее выдвигались предположения о том, что адипоциты к тому же являются и иммунологически активными клетками. Недавнее исследование учёных из США показало, что адипоциты могут защищать организм от развития опасных кожных и инвазивных инфекций, вызываемых Staphylococcus aureus [1].
Клетки vs. бактерии
В целом, в защиту организма от вредоносных микробов включается несколько типов клеток. Поскольку микроб делится очень быстро, необходимо обеспечивать и столь же быстрый локальный иммунный ответ на инфекцию. В этот процесс вовлекаются эпителиальные клетки, мастоциты (тучные клетки) и тканевые лейкоциты. Важно также успеть ограничить распространение инфекции до тех пор, пока на помощь не подоспеют и другие защитные клетки — нейтрофилы и моноциты [2]. Основным механизмом для ограничения роста патогена служит выделение клетками антимикробных пептидов. Антимикробные пептиды играют решающую роль в ограничении распространения бактерий по коже и слизистым поверхностям, а также предотвращают их распространение в глубокие ткани, где инфекция может развиваться [3].
Staphylococcus aureus, или золотистый стафилококк, — это один из самых известных и опасных микробов. Он является основной причиной большинства инфекций кожи и мягких тканей человека, вызывает очаговые и системные заболевания. Зачастую именно этот микроб является причиной септического шока — смертельно опасного осложнения тяжёлых инфекционных заболеваний [6].
Адипоциты оберегают нас от стафилококка
Так чем же примечательны адипоциты в качестве клеток, помогающих нашему иммунитету? Исследователи выяснили, что, с одной стороны, на инфекцию отвечают уже зрелые адипоциты, присутствующие в организме хозяина на момент заражения. С другой стороны, инфицирование ускоряет синтез новых адипоцитов. Как они это обнаружили?
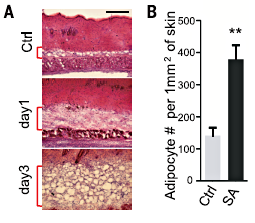 Рис. 2. Возрастание количества адипоцитов при заражении стафилококком. А — окрашивание кожи мышей гематоксилином и эозином. Ctrl — контроль, day 1 и day 3 — демонстрация увеличения слоя адипоцитов после инфицирования S. aureus; B — количество адипоцитов у мышей контрольной группы (Ctrl) и мышей, заражённых стафилококком (SA).
Рис. 2. Возрастание количества адипоцитов при заражении стафилококком. А — окрашивание кожи мышей гематоксилином и эозином. Ctrl — контроль, day 1 и day 3 — демонстрация увеличения слоя адипоцитов после инфицирования S. aureus; B — количество адипоцитов у мышей контрольной группы (Ctrl) и мышей, заражённых стафилококком (SA).
Исследуя золотистых стафилококков и инфицируя ими кожу мышей, учёные заметили одну интересную особенность — в ответ на заражение подкожный жировой слой мышки заметно увеличивался (рис. 2А). Также увеличилось и количество адипоцитов (рис. 2В). После инфицирования золотистым стафилококком адипоциты начинают постепенно увеличиваться в размере, то есть увеличение жировой ткани частично вызвано гипертрофией уже зрелых адипоцитов (рис. 3). Было показано, что кожные клетки, выделенные из зоны, инфицированной бактерией, обладают большим адипогенным потенциалом (то есть клетки адипоцитов там делятся быстрее обычного) по сравнению с клетками из незаражённой зоны (рис. 2В). Также увеличивается и количество транскрипционных факторов, необходимых для дифференцировки преадипоцитов (предшественников жировых клеток) в адипоциты. Чтобы выявить пролиферирующие (то есть активно делящиеся) клетки-преадипоциты учёные использовали бромдезоксиуридин (БДУ, BrdU). БДУ способен заменять тимидин в процессе репликации ДНК, таким образом встраиваясь в новую ДНК. Последующее иммуногистохимическое окрашивание с антителами к бромдезоксиуридину позволяет обнаружить включённый модифицированный нуклеозид, и тем самым выявить пролиферирующие клетки [7]. Оказалось, что в мышах, инфицированных стафилококком, значительно увеличивалось количество клеток с ядрами, содержащими в себе BrdU. Это подтвердило идею о том, что часть адипоцитов синтезировалась de novo в ответ на инфекционный агент. Также было установлено, что нарушение адипогенеза сопровождается повышением чувствительности к стафилококковой инфекции и вызывает системную бактериемию (циркуляцию бактерий в крови).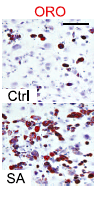
Рис. 3. Oil-Red-O (ORO) окрашивание дермальных клеток контрольной группы (Ctrl) и клеток, заражённых S. aureus (SA) для демонстрации продукции липидов.
Секретное оружие адипоцитов
Следующий вопрос, который заинтересовал учёных, — каким образом адипоциты могут защищать организм от инфекции? Было установлено, что в дифференцированных адипоцитах резко возросло количество антимикробного пептида кателицидина (cathelicidin antimicrobial peptide, Camp), тогда как количество других антимикробных пептидов оставалось прежним. Аналогичные опыты на клеточной культуре человеческих адипоцитов также показали наличие в них предшественника кателицидина. Интересным оказалось и то, что если посеять золотистого стафилококка на ту же питательную среду, где ранее росли предшественники адипоцитов, секретировавшие кателицидин, рост бактерий сильно замедляется. Мыши, в которых специально тормозился рост жировых клеток, показывали сниженную устойчивость к стафилококку, и это прямо коррелировало с уменьшением в их жировой прослойке кателицидина.
Поможет ли лишний вес в борьбе с инфекцией?
Суммируя всё вышеописанное, можно сказать, что локальное увеличение подкожных адипоцитов является важным процессом в ответе организма на инфицирование кожи. Ранее было известно то, что адипоциты способны секретировать биоактивные вещества — адипокины и цитокины, которые опосредуют различные посттравматические иммунные реакции [8]. Данное исследование только подтверждает эти факты. Местное утолщение подкожного жира обеспечивает синтез кателицидина в ответ на инфекцию. Также эта реакция может иметь косвенную выгоду для иммунной защиты, например, способствовать образованию активных форм кислорода, радикалов и окиси азота, обладающих бактерицидной активностью (индуцировать так называемый окислительный взрыв).
Однако всё это не означает, что теперь необходимо срочно набирать вес. Причин тому две:
- Резкое локальное повышение уровня кателицидина более эффективно обеспечивает антимикробные функции, чем небольшое увеличение системного кателицидина в результате ожирения. Для мышей, страдающих ожирением, данные оказались удручающими — вырабатываемые ими антимикробные пептиды являлись «бракованными», что делало таких мышей более восприимчивыми к инфекции [9].
- Кателицидин — провоспалительное вещество, то есть способствует процессу воспаления. Именно поэтому у людей, страдающих ожирением, в организме зачастую протекают реакции хронического воспаления [8, 10].
Вывод статьи прост — во всём хороша мера, и нужно искать некую золотую середину. Безусловно, изнурение своего организма диетами не может привести ни к чему хорошему. Так же как и ожирение не способствует общему оздоровлению. Питайтесь правильно, следите за здоровьем и не беспокойтесь, если у вас появилась лишняя складочка — возможно, именно сейчас организм помогает вам. Поэтому поддержите его в этом начинании, съешьте какой-нибудь витаминный фрукт и скажите «спасибо» своим полезным адипоцитам.
Рис. 4. Самое главное — это правильное питание: как без строгих диет, так и без «вредной» еды, приводящей к ожирению. Будьте здоровы!
Литература:
- Zhang L., Guerrero-Juarez C.F., Hata T., Bapat S.P., Ramos R., Plikus M.V., Gallo R.L. (2015). Dermal adipocytes protect against invasive Staphylococcus aureus skin infection. Science 347, 67–71;
- Nestle F.O., Di Meglio P., Qin J.Z., Nickoloff B.J. (2009). Skin immune sentinels in health and disease. Nat. Rev. Immunol. 9, 679–691;
- Nizet V. et al. (2001). Innate antimicrobial peptides protects the skin from invasive bacterial infection. Nature 414, 454–457;
- биомолекула: «Антимикробные пептиды — возможная альтернатива традиционным антибиотикам»;
- биомолекула: «Невидимая граница: где сталкиваются “нано” и “био”»;
- Miller L.S., Cho J.S. (2011). Immunity against Staphylococcus aureus cutaneous infection. Nat. Rev. Immunol. 11, 505–518;
- Wilson G.D. et al. (1988). Measurement of cell kinetics in human tumours in vivo using bromodeoxyuridine incorporation and flow cytometry. Br. J. Cancer. 58, 423;
- Schaffler A., Schalmerich J. (2010). Innate immunity and adipose tissue biology. Trends Immunol. 31, 228–235;
- Cawthorn W.P., Scheller E.L., MacDougald O.A. (2012). Adipose tissue stem cells meet preadipocyte commitment: going back to the future. J. Lipid Res. 53, 227–246;
- Yamasaki K. et al. (2007). Increased serine protease activity and cathelicidin promotes skin inflammation in rosacea. Nat. Med. 13, 975–980.
Оксана ГОРЯЙНОВА
По материалам Биомолекула