Безыгольная мезотерапия: научный подход
Мезотерапия (или интрадермотерапия) изобретена в 1952 году Мишелем Пистором. Только в 1958 году в статье «Обзор новых свойств прокаина» он изложил выводы о результатах проведения локальной инъекции новокаина (прокаина) при лечении глухоты, шума в ушах, головокружения, головных болей и возрастной дальнозоркости [28]. Хотя именно Пистору принадлежит главная роль в «открытии» мезотерапии, но и до него проводились подобные эксперименты. В 1884 году офтальмолог доктор Карл Коллер для обезболивания использовал местно кокаин. В 1904 году немецкий химик доктор Альфред Айнхорн открыл новый анестетик – прокаин, который он запатентовал под названием «новокаин». В 1925 году профессор Рене Лериема пытался делать подкожные инъекции в межрёберные участки, а в 1937 году доктор Арон опубликовал исследование о подкожных инъекциях гистамина [33]. На самом деле история мезотерапии восходит к практике Гиппократа (400-е годы до нашей эры), который лечил пациентов, применяя опунцию (растение семейства кактусовых). Благодаря публикации во французской прессе трудов Пистора (1958) появился термин «мезотерапия», но только 30 лет спустя в 1987 году Французская медицинская академия признала мезотерапию и выделила её как специальность традиционной медицины [30].
Однако в большинстве публикаций, посвящённых использованию мезотерапии, особое внимание уделялось осложнениям после применения этого метода. Наиболее тяжёлыми и часто встречающимися осложнениями являются микобактериальные инфекции, которые обычно приводят к грубым шрамам. Достаточно распространённые осложнения: лихеноидная сыпь, манифестация псориаза, крапивница, кожные некрозы, системная красная волчанка, панникулит, aхромия, атрофия и др. Указанные осложнения, как правило, появляются вследствие нарушения техники процедуры и самолечения [12]. Выявленные недостатки вынудили производителей медицинского оборудования развивать новые альтернативные системы доставки препарата. Разработанные устройства для безыгольной мезотерапии весьма привлекательны для эстетической практики, особенно высоко их оценили специалисты, практикующие обычные инъекционные техники.
Безыгольная мезотерапия
Выраженный липофильный характер рогового слоя препятствует пассивному транспорту макромолекул через кожу [8]. Проводились многочисленные исследования, направленные на изучение структуры рогового слоя [17]. В ряде публикаций рассматривался вопрос преодоления основного барьера с использованием различных физических и химических методов [3, 34]. Выяснили, что лекарственные вещества могут проникать через кожу 3 различными путями (Рис. 1):
- через потовые каналы (протоки);
- через волосяные фолликулы и сальные железы (именуемые шунт или appendageal);
- непосредственно через роговой слой.
Рис. 1. Пути проникновения через кожу: 1 – через потовые протоки; 2 – непосредственно через роговой слой; 3 – через волосяные фолликулы [17].
При выполнении технологии безыгольной мезотерапии в зависимости от индивидуальных ощущений пациента, способности к абсорбции и природы используемых активных молекул выбирают один из этих путей. Благодаря современным научным достижениям производители медицинских приборов смогли реализовать доставку активных субстанций через эпидермис, достигая при этом значительного проникновения в глубокие слои ткани, с эффективностью не меньшей, чем при инъекциях с помощью шприца. Безыгольные технологии включают: аквафорез, магнитофорез, сонофорез (фонофорез), безыгольные инъекции, ионофорез и электропорацию.
Магнитофорез
Этот метод предполагает использование низкочастотного магнитного поля, которое служит внешней движущей силой для повышения диффузии диамагнитных молекул через кожу. Воздействие магнитного поля индуцирует структурные изменения рогового слоя, которые приводят к увеличению проницаемости кожи. В ходе лабораторных исследований in vitro изучали влияние магнитофореза на доставку лекарственных средств. Мерфи (1999) показал магнитоиндуцированное повышение скорости потока бензойной кислоты. Были опубликованы данные о влиянии магнита на повышение трансдермального проникающего потока сульфата тербуталина из прикреплённых к коже пластырей [23]. Однако эта методика может применяться только для диамагнитных молекул, что объясняет потерю интереса к магнитофорезу [4].
Сонофорез (фонофорез)
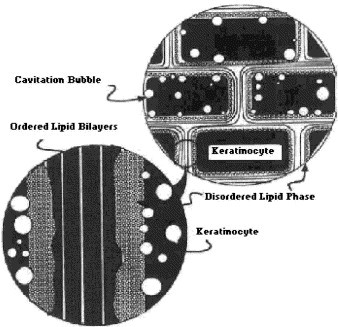
Этот метод основан на использовании энергии низкочастотного ультразвука для повышения трансдермальной доставки местно применяемых препаратов. Реализация этого механизма изучается уже более 50 лет [19]. В результате применения ультразвука возникают тепловой или нетепловой эффекты. Воздействие ультразвука на кожу может привести к значительному локальному нагреву, вследствие которого ускоряются диффузия и поглощение препарата, увеличивается его растворимость. Кроме того, ультразвук способствует усилению местного кровотока. Однако, по мнению ряда исследователей [22], самое важное следствие ультразвука – кавитация, которая приводит к росту и колебанию газообразных полостей (пузырьков воздуха). Коллапс пузырьков воздуха приводит к генерации высоких ударных давлений, которые способны разрушать роговой слой (Рис. 2).
Рис. 2. Механизм воздействия кавитации на кератиноциты. Кавитация возникает преимущественно на границе кератиноцитов и липидного бислоя [7].
Такие параметры ультразвука, как интенсивность и частота, влияют на чрезкожное поглощение и, как следствие, на продолжительность лечения. При этом параметр частоты, как известно, крайне важен [25]. Частоты в низком диапазоне (<100 кГц), как полагают, имеют более существенное влияние на трансдермальную доставку макромолекул лекарств с молекулярной массой до 48 кДа [17]. Но сонофорез должен преодолеть подобные препятствия. Таким образом, чтобы добиться хороших результатов, необходимо объединить кавитацию и ультразвук с другими физическими и химическими факторами, например, с энхансерами, ионофорезом и электропорацией [31].
Безыгольная инъекция
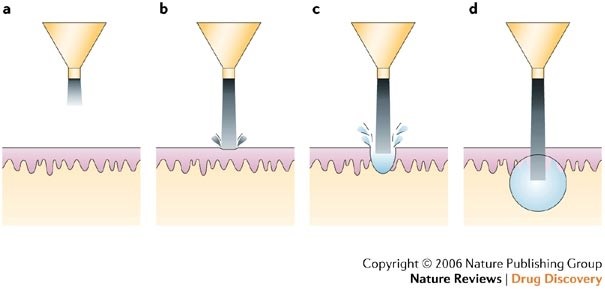
Метод предусматривает трансдермальную доставку лекарственных веществ сверхзвуковыми скоростями сквозь внешние слои кожи путём обжига жидких или твёрдых частиц с помощью подходящего источника энергии. Доставка осуществляется за счёт высокой скорости и высокого давления [17]. Безыгольные инъекции изучались с 1930 года. За эти годы были перепробованы различные жидкие и порошковые системы (Рис. 3). По данным Матура и соавт. [17], порошковые системы использовались для доставки тестостерона, лидокаина гидрохлорида, а также макромолекул кальцитонина и инсулина. Жидкость из резервуара попадает в поршень под давлением и выстреливает струёй с высокой скоростью (>100 мс-1). Струя инициирует образование отверстия в коже, образуя практически сферическую форму [20]. На Рис. 3 показан процесс инъекции.
Рис.3. Схематическое изображение процесса инъекции струи.
Недостатки безыгольных инъекций заключаются в высокой стоимости лекарственной формы и невозможности программировать или контролировать доставку лекарств с учётом внутренних особенностей проницаемости кожи. Кроме того, отдалённые эффекты высокоскоростной «бомбардировки» кожи лекарственными частицами не изучены [4]. При этом препараты подвергаются воздействию высоких напряжений во время инъекции, что может негативно повлиять на структурную целостность больших молекул, таких как белки, вакцины и ДНК [20].
Ионофорез
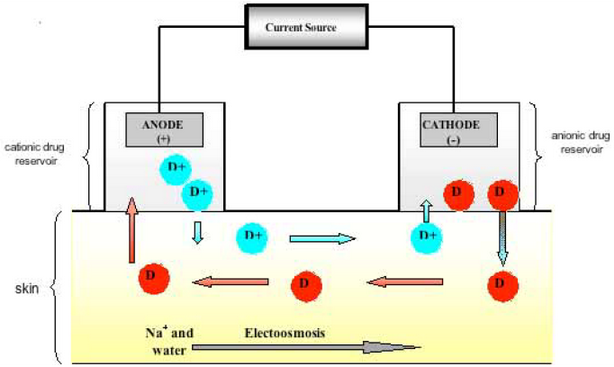
Этот метод имеет вековую историю. Со временем ионофорез стал одним из наиболее популярных и востребованных методов на эстетическом рынке. Усиление трансэпидермальной доставки лекарственного средства осуществляется за счёт применения электрического тока малой силы и низкого напряжения (гальванического тока примерно 0,5 мА/см2) [22]. Устройство для ионофореза состоит из источника питания, с положительным (анодом) и отрицательным (катодом) электродами (Рис. 4). Доставка положительно заряженного вещества (D+) может быть достигнута путём его растворения вблизи электрода подобной полярности (анод). При применении постоянного тока лекарственное вещество отталкивается от анода и перемещается к противоположно заряженному электроду (катоду) [2]. Аналогичным образом происходит доставка отрицательно заряженных лекарственных средств – анионов (D- отталкиваются от катода к аноду) [22].
Рис. 4. Схема ионофореза. Устройство состоит из источника питания, соединённого с положительно заряженным (анод) и отрицательно заряженным (катод) электродами [22].
На систему ионофорезной доставки препарата в кожу влияют тип электрода, сила тока, рН системы, конкурентоспособность иона и способ проникновения. Ограничения на применение ионофореза включают в себя нормативные требования к силе тока, который можно использовать, воздействуя на организм человека (в настоящее время установлена сила тока 0,5 мА/см2), и риск необратимых повреждений барьерных свойств кожи [17]. Кроме того, с помощью ионофореза не удалось существенно улучшить трансдермальную доставку макромолекул >7000 Da [13]. Следовательно, ионофорез целесообразно использовать для улучшения трансдермальной доставки широкого спектра сравнительно небольших молекул (например, апоморфина, rotigotine и т. д.) [17].
Электропорация
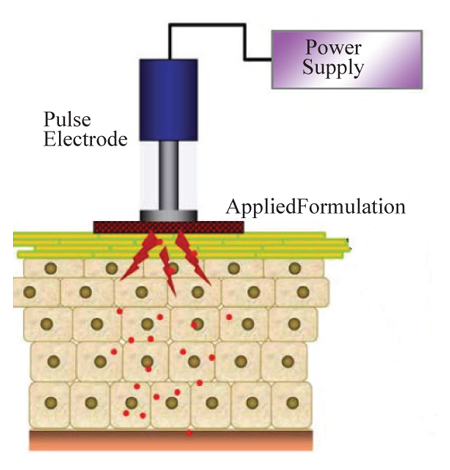
Наряду с ионофорезом электропорация является наиболее популярной технологией на эстетическом рынке. Электропорация (электропермеабилизация) – технология воздействия на кожу, предполагающая применение высоковольтных импульсов. Чаще всего используется высокое напряжение (≥100 В) с короткой продолжительностью воздействия (миллисекунды) [1]. Схема электропорации приводится на Рис. 5. С помощью этой технологии успешно удаётся повышать проницаемость кожи для проникновения молекул различной липофильности и размеров (например, небольшие молекулы, белки, пептиды и олигонуклеотиды), в том числе и для биофармацевтических препаратов с молекулярным весом >7 кДа (в настоящее время это предел для ионофореза [6, 17].
Рис. 5. Схема электропорации [32].
Процесс электропорации. При применении интенсивного трансмембранного электрического поля, превышающего прочность клеточных мембран, возрастает специфичная проводимость мембран [35]. Увеличение проницаемости кожи вызвано генерированием электропорацией переходных конформаций мембраны, что обусловлено относительно слабой природой гидрофобно/гидрофильных взаимодействий фосфолипидного бислоя и его способностью самостоятельно восстанавливаться (Рис. 6) [29]. Переходный период проходит в 3 этапа. При воздействии электрического поля в клеточной мембране появляются водные дефекты. Если эти дефекты достаточно стабильны, они приводят к созданию водного депо или гидрофобным порам в мембране. В конечном счёте фосфолипиды перестраиваются с образованием более стабильной и гидрофильной структуры [16].
Рис. 6. Схематическое изображение структуры переходных конформаций мембраны вследствие электропорации: после воздействия сильного электрического поля происходит перестройка клеточной мембраны с порообразованием [10].
Научная основа для электропорации. Электропермеабилизацию как метод повышения диффузии через биологические барьеры пытались использовать 100 лет назад [11]. Развитие этого метода частично основано на открытии Вильгельма Оствальда, Нобелевского лауреата по химии (1909 год). В 1890 году профессор Вильгельм Оствальд предположил, что электрические импульсы, открытые в живой ткани, могут являться следствием движения ионов через клеточные мембраны и обратно. Электрохимические идеи Оствальда достаточно быстро получили признание.
Первоначально технология электропорации была разработана для введения в клетки молекул ДНК [27]. На основе теоретических и экспериментальных исследований двухслойной мембраны в конце 1960-х и в 1970-е годы проводились подобные опыты. С 1980-х годов в научной литературе появилось много сообщений об использовании электропорации для генной терапии, вакцинации, увеличения поглощения в опухолях химиотерапевтического агента и преобразования ДНК [9].
Сравнительное изучение электропорации и ионофореза. Электропорация обусловливает обратимую проницаемость липидного бислоя, создавая водный путь для применения электрического импульса [1]. В отличие от электропорации ионофорез в первую очередь осуществляет транспорт препарата по уже имеющемуся пути [5], например, через потовые железы и волосяные фолликулы [1]. В то время как при электропорации путь доставки препарата является внутриклеточным, в ионофорезе – межклеточным, между существующим путём и клетками эпидермиса [21]. Поэтому при одинаковых усилиях эффект доставки препарата (скорость проникновения и скорость поглощения) методом электропорации значительно выше, чем при ионофорезе [6].
Поскольку механизм доставки лекарственного вещества при этих электрических манипуляциях различен, понятны и различия в ограничении по молекулярному весу доставляемых препаратов. В то время как метод электропорации способен транспортировать молекулы с большим молекулярным весом, возможности ионофореза ограничены молекулярным весом вещества до 7 кДа.
Кроме того, механизм доставки препарата методом ионофореза реализуется только для веществ, способных образовывать заряженные молекулы. А механизм доставки методом электропорации предусматривает способность препарата растворяться в воде, а также этот метод возможно использовать для всех полярных, не имеющих заряда лекарственных средств.
Рис.7. Схематическое изображение показывает пути трансдермальной доставки, в том числе и с помощью электрической доставки ионофореза и электропорации .
Существует определённая путаница в терминологии. Например, когда речь идет об использовании термина «электропорация» применительно к воздействию гальваническим током (электрофорез). Это очень типичная и распространённая ошибка. Термины «электропорация», «электротранспорт» или «электропермиабилизация» можно употреблять, когда речь идёт о применении электрического тока любого типа.
Ошибки в терминологии часто происходят при описании пор (аквапорины), которые создаются путём электропорации. Это типичная ошибка является следствием того, что поры, созданные методом электропорации, описываются как водные пути. После воздействия методом электропорации мембраны приобретают высокий уровень заряда и вода нагнетается в липидную среду. Как только водный канал сформировался, вода становится поляризованной, в результате чего стабилизируется порообразование [26, 27]. Но эти водные каналы являются временными структурами в мембране и не имеют ничего общего с клеточными водными каналами – аквапоринами. Аквапорины – это большое семейство трансмембранных белков, участвующих в трансэпителиальном и трансцеллюлярном движении воды. Аквапорины делятся на 2 группы: первые – отвечают только за транспорт воды, а вторые участвуют также в транспорте глицерина и других малых молекул, в частности молочной кислоты [14]. Кроме того, аквапорины активируются витаминами, стероидами и другими химическими веществами, но нейтральны к влиянию электрических импульсов (например, ионных каналов). Поэтому эти белки (даже в совокупности) не могут быть вовлечены в поставку молекул лекарственных средств.
Другая распространённая ошибка заключается в том, что якобы все устройства на основе технологии электропорации одинаково эффективны. Хотя все эти приборы применяют высокие напряжения, они различаются по форме волны, скорости и силе тока [1]. За последние 3 десятилетия оборудование для электропорации существенно усовершенствовано: появилась возможность независимого контроля амплитуды и длительности, оптимизируются также способы доставки молекул. Постоянно ведутся научные исследования по разработке методов доставки лекарств с помощью различных технических средств [9].
Поиск идеального энхансера для доставки лекарств в кожу был в течение нескольких десятилетий в центре научного внимания. Однако, несмотря на появление на рынке мощных энхансеров, в большинстве случаев их воздействие было сопряжено с повышенной токсичностью, что значительно ограничивало их практическое применение. Результаты последних биофизических исследований позволили продвинуться в понимании природы барьера рогового слоя, а также в изучении способности химических веществ влиять на структуру рогового слоя. Знание механизмов взаимодействия энхансеров с роговым слоем поможет в разработке аппаратов с оптимальными характеристиками и минимальной токсичностью [17].
Для пациентов, которые боятся уколов или не готовы рисковать, помня о возможных осложнениях, а также тех, кто не имеет возможности или желания тратить время на реабилитацию после инвазивной мезотерапии, техника неинвазивной трансдермальной доставки препарата обладает выраженными преимуществами перед инъекцией или внутривенным введением препарата. Важен неинвазивный характер процедуры, её удобство, отсутствие травм и побочных эффектов [15]. Несмотря на необходимость более высоких доз препарата и большее количество процедур, большинство пациентов предпочитают неинвазивную процедуру инъекционной при условии достижения благоприятных результатов. Однако многие врачи сочетают традиционные приёмы мезотерапии с помощью инъекций с безыгольной технологией. Так, например, дерматологи часто вводят с помощью инъекций гиалуроновую кислоту в носогубные складки, а затем используют неинвазивные устройства для введения гиалуроновой кислоты, витамина С и других веществ для общей терапии кожи лица.
Эффективность доставки активных веществ в ткани на значительную глубину зависит от концентрации и количества поставляемого вещества. Приёмы доставки и проникновения вещества должны быть быстрыми. Рассматриваемая технология доставки активного вещества должна не уступать по эффективности инъекциям с помощью шприца. Понимание технологических различий и особенностей методов может оказать существенное влияние на выбор специалистом соответствующего оборудования для успешного решения проблемы пациента.
Литература:
- Bangaa A.K., Boseb S., Ghoshc T.K. Iontophoresis and electroporation: comparisons and contrasts // Int. J. of Pharm. – 1999. – 179; 1–19.
- Barry B.W. Novel mechanisms and devices to enable successful transdermal drug delivery // Eur. J. Pharm. Sci. – 2001. – 14; 101–114.
- Bronaugh R.L., Maibach H.I. (Eds.). Percutaneous Absorption, Mechanisms–Methodology–Drug Delivery. – Marcel Dekker, New York, 1989.
- Brown M.B., Traynor M.J., Martin G.P., Akomeah F.K. Transdermal drug delivery systems: skin perturbation devices // In Methods in Molecular Biology. – 2008. – Vol. 437; Springer (Humana Press). – P. 119–139.
- Cullander C. What are the pathways of iontophoretic current flow through mammalian skin? // Adv. Drug Deliv. – 1992. – 9; 119–135.
- Denet A.R., Vanbever R., Preat V. Skin electroporation for topical and transdermal delivery // Adv. Drug Deliv Rev. – 2004. – 56; 659–674.
- Escobar-Chávez J.J., Bonilla-Martínez D., Villegas-González M.A., Rodríguez-Cruz I.M., Domínguez-Delgado C.L. The use of sonophoresis in the administration of drugs throughout the skin // J. Pharm. Pharm. Sci. – 2009. – 12; 88–115.
- Flynn G.L. Mechanism of percutaneous absorption from physicochemical evidence. In: Bronaugh R.L., Maibach, H.I. (Eds.), Percutaneous Absorption, Mechanisms–Methodology–Drug Delivery. – Marcel Dekker, New York, 1989. – P. 27–51.
- Gehl J. Electroporation: theory and methods, perspectives for drug delivery, gene therapy and research // Acta Physiol Scand. – 2003. –177; 437–447.
- Giardino R., Fini M., Bonazzi V., Cadossi R., Nicolini A., Carpi A. Electrochemotherapy a novel approach to the treatment of metastatic nodules on the skin and subcutaneous tissues // Biomed Pharmacother. – 2006. – 60; 458–462.
- Helmstodter A. The history of electrically assisted transdermal drug delivery (iontophoresis) // Pharmazie. – 2001. – 56; 583–587.
- Herreros F.O., Moraes A.M., Velho P.E. Mesotherapy: a bibliographical review // An Bras Dermatol. – 2011. – 86; 96–101.
- Kanikkannan N. Iontophoresis based transdermal delivery systems // Biodrugs. – 2002. – 16; 339–347.
- King L.S., Agree P. Pathophysiology of the aquaporin water channels // Ann Rev Physiol. –1996. – 58; 619–648.
- Kronemyer B. Study Confirms Electroporation Advantage 500 Times More Effective vs. Iontophoresis // Aesthetic Buyers Guide September/October. – 2007. (www.miinews.com)
- Le Gac S., van den Berg A. Single cell electroporation using microfluidic devices // Methods Mol Biol. – 2012. – 853; 65–82.
- Mathur V., Satrawala Y., Rajput M.S. Physical and chemical penetration enhancers in transdermal drug delivery system // Asian J Pharm. – 2010. – 4; 173–183.
- Mitragotri S., Kost J. Low-frequency sonophoresis: a review // Adv. Drug Deliv Rev. – 2004. – 56; 589–601.
- Mitragotri S. Healing sound: the use of ultrasound in drug delivery and other therapeutic applications // Nat Rev Drug Discov. – 2005. – 4; 255–260.
- Mitragotri S. Current status and future prospects of needle-free liquid jet injectors // Nat Rev Drug Discov. – 2006. – 5; 543–548.
- Monteiro-Riviere N.A., Inman A.O., Riviere J.E. Identification of the pathway of iontophoretic drug delivery: light and ultrastructural studies using mercuric chloride in pigs // Pharm. Res. – 1994. – 11; 251–256.
- Morrow D.I.J., McCarron P.A., Woolfson A.D., Donnelly R.F. Innovative strategies for enhancing topical and transdermal drug delivery // Open Drug Deliv J. – 2007. – 1; 36–59.
- Murthy S.N., Hiremath R.R. Physical and chemical permeation enhancers in transdermal delivery of terbutaline sulphate //AAPS PharmSciTech. – 2001. – 2; 1–5.
- Murthy S.N. Magnetophoresis: an approach to enhance transdermal drug diffusion // Pharmazie. – 1999. – 54; 377–379.
- Naik A., Kalia Y.N., Guy R.H. Transdermal drug delivery: overcoming the skin’s barrier function // Research focuses. – 2000. – 3; 318–326.
- Neumann E., Schaefer-Ridder M., Wang Y., Hofschneider P.H. Gene transfer into mouse lyoma cells by electroporation in high electric fields // EMBO J. – 1982. – 7; 841–845.
- Neumann E., Sowers A., Jordan C. Electroporation and Electrofusion in Cell Biology // Plenum Press; New York, 1989.
- Pistor M. What is mesotherapy? // Chir Dent Fr. – 1976. – 46; 59–60.
- Purves W.K., Sadava D., Orians G.H., Heller H.C. Life: The Science of Biology- 6th ed // Sinauer Associates. – 2001. – P. 316–317.
- Raghvendra K., Satyanand T., Pramod Y., Sunanda S., Rajesh A.D., Tanvi D.P. Mesotherapy a non-surgical cosmetic medicine treatment: a review // Int J. of Pharm. Sci. Rev and Res. – 2010. – 4; 45–47.
- Rao R., Nanda S. Sonophoresis: recent advancements and future trends // J Pharm Pharmacol. – 2009. – 61; 689–705.
- Rolf D. Strategies for Skin Penetration Enhancement // Skin care forum. – 2004. – 37.
- Rotunda A.M., Kolodney M.S. Mesotherapy and phosphatidylcholine injections: historical clarification and review // Dermatol Surg. – 2006. – 32; 465–480.
- Singh S., Singh J. Transdermal drug delivery by passive diffusion and iontophoresis: a review // Med Res Rev. – 1993. – 13; 569–621.
- Tsong T.Y. Electroporation of cell membranes // Biophys J. – 1991. – 60; 297–306.
- Weaver J.C., Vaughan T.E., Chizmadzhev Y.A. Theory of electrical creation of aqueous pathways across skin transport barriers // Adv. Drug Deliv Rev. – 1999. – 35; 21–39.
Инна БЕЛЕНЬКАЯ — доктор биологических наук, биохимик
Ариэль МАРГУЛИС — врач, доктор медицинских наук
По материалам «Экспериментальная и клиническая дерматокосметология»